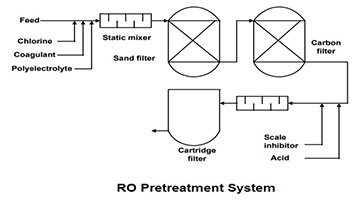
بررسی آنالیز آب جهت طراحی پيش تصفيه سیستم اسمز معکوس RO لیان تدبیر
چرا واحد پيش تصفيه در سیستم اسمز معکوس RO ضروری است؟
هدف از پيش تصفيه در سیستم اسمز معکوس RO، افزايش بازدهي و طول عمر غشاي اسمز معکوس RO است. تجهيزات پيش تصفيه اسمز معکوس RO به منظور رسيدن به اهداف زير طراحي ميشوند.
1- از مناسب بودن كيفيت آب تغذیه (Feed Water) براي ممبران های سیستم اسمز معکوس RO اطمينان حاصل شود.
2- احتمال تشكيل رسوب بر روي ممبران های سیستم اسمز معکوس RO حذف و يا به حداقل ممكن كاهش داده شود.
3- شستشوي شيميايي ادواري(CIP) ممبران های سیستم اسمز معکوس RO به واسطه كاهش پتانسيل گرفتگي در جریان آب تغذیه، كاهش يابد.
ضرورت واحد پيش تصفيه در سیستم اسمز معکوس RO
ممبران های سیستم اسمز معکوس RO، توسط مواد زیر دچار فولینگ می شوند:

سازگاری غشا یا ممبران های سیستم اسمز معکوس RO
در صورتیکه انتظار داريم كه عمر ممبران های سیستم اسمز معکوس RO، طولاني و استفاده از آن مقرون به صرفه باشد، حلاال و مواد محلول در آن (كه در فرآيند اسمز معكوس دخالت دارند) بايد با ممبران های سیستم اسمز معکوس RO سازگاري داشته باشند. به منظور بهرهبرداري موفقيتآميز از سیستم اسمز معکوس RO، لازم است در صورتي كه در آب خوراك، موادی وجود دارند كه امكان جذب آنها بر روي ممبران های سیستم اسمز معکوس RO به طور عمده وجود دارد و يا هر ماده ديگري كه بتواند وارد ساختمان غشا شود، هردوي اين تركيبها بايد حذف شوند و در صورتي كه اين امكان وجود ندارد بايد از ممبران های سیستم اسمز معکوس RO با جنس ديگري استفاده شود. متداولترين مثال اين نوع سازگاري، حذف كلر آزاد يا كلرامين از آب خوراك غشاي پلي آمید سیستم اسمز معکوس RO است. اگر اين اجزا از آب خوراك حذف نشوند، پيشبيني ميشود كه ممبران های سیستم اسمز معکوس RO طول عمر كمتري خواهد داشت.
در موارد خاصي، بعضي وقتها لازم است كه عمر غشا كاهش يابد. بعضي اوقات حذف آلودگي از جريان آب خوراك به هيچ وجه امكانپذير نيست و بنابراين، كاهش عمر ممبران های سیستم اسمز معکوس RO از نظر اقتصادي توجيهپذير است.
سازگاری ممبران های سلولز استات در سیستم اسمز معکوس RO
غشاي سلولز استات برعكس غشاي پلي آميد، در مقابل عوامل اكسيد كننده كه در اكثر منابع آب شهري وجود دارد، مقاوم است. اكثر غشاهای سلولز استات به آساني 1 ppm كلر آزاد موجود در آب خوراك را تحمل ميكنند.
غشاهای پلی آمید در مقابل تغييرات زياد pH از خود مقاومت نشان ميدهد، ولي غشاي سلولز استات، اين خصوصيت را ندارد. در بعضي موارد، سلولز استات در آب، ناپايدار است. سرعت اين عمل، هيدروليز ناميده ميشود و بستگي به pH و دماي آب خوراك دارد. اگر pH در محدود مطلوب قرار بگيرد، عمر اين ممبران های سیستم اسمز معکوس RO طولانيتر خواهد شد.
كاهش هيدروليز ممبران های سیستم اسمز معکوس RO با كنترل pH بمنظور پیش تصفیه RO
جهت كاهش هيدروليز ممبران های سیستم اسمز معکوس RO ، باید نوع آن غشا شناسایی و محدودیت های pH آب ورودی به آن ها رعایت گردد، اگرغشاهاي از جنس سلولزاستات با pH بيش از 7 براي مدت طولاني مورد استفاده قرار بگيرد، احتمال كاهش عمر آنها وجود دارد.
به اين دليل كه غلظت يون بيكربنات در اكثر منابع آب، در جريان تغليظ شدهConcentrate ، بيشتر است جريان آب تغليظ شده داراي pH بيشتري نسبت به آب خوراك است. به همین جهت ممبرانهایی كه در انتهاي سيستم قرار دارند (به عنوان مثال، غشاهایی كه آب دورريز مراحل اوليه به عنوان آب خوراك آن ها استفاده ميشود)، دارای pH بالاتری نسبت به آب خوراك باشند. در سيستمهاي RO كه راندمان آن ها 75% است، معمولاً pH آب تغليظ شده حدوده 5/0 واحد از pH آب تغذیه بيشتر است. در نتيجه، كاهش كارآيي غشا به دليل وابستگي شدت هيدروليز به pH ، در غشاهای انتهايي سيستم اتفاق خواهد افتاد. (غشاهای مرحله دوم و يا سوم)
معمولاً pH مطلوب براي ممبرانهای استات سلولزُ منحصراً براساس به حداقل رساندن سرعت هيدروليز غشا تعيين نميشود. براي دستيابي به pH بهينهي 8/4، احتياج به اين است كه تقريباً تمام قلياييت موجود در آب به دياكسيدكربن تبديل شود. غلظت واقعي اسيد در آب به غلظت قلياييت بستگي دارد.
تزريق اسيد اضافي بدون وجود قلياييت به آب، تأثير بسزايي در pH آب دارد. بنابراين، در اكثر موارد كاربرد، كنترل pH آب خوراك در حد 8/4 جهت به حداقل رساندن هيدروليز غشا غير ممكن و يا مشكل است.
در اكثر صنايعي كه از سيستم اسمز معکوس RO با غشاي استات سلولز استفاده ميكنند، pH آب خوراك آنها بين 5/5 تا 5/6 است. در حقيقت، pH عملياتي براساس محلول نگهداشتن كربنات كلسيم در جريان آب تغليظ (جلوگيري از رسوب) تنظيم ميشود و بعد از آن، سرعت هيدروليز غشای استات سلولز مدنظر قرار ميگيرد.
در سيستمهاي كوچك اسمز معکوس RO كه از غشاهاي استات سلولز با بازدهي پايين استفاده ميكنند، ممكن است pH برابر 8، براي آب خوراك از نظر اقتصادي مقرون به صرفه باشد. هزينه نگهداري و سفارش خريد قطعات مختلف جهت سيستم كنترل pH، نسبت به هزينه خريد ممبرانهای جديد، بيشتر است. معمولا كارخانههاي سازنده غشا و سيستم اسمز معکوس RO ، دارای استانداردهای منحصر به خود می باشند.
براي تنظيم pH از اسيد سولفوريك استفاده ميشود به اين دليل كه اولاً، ارزان قيمت است و ثانياً، نسبت به اسيد كلريدريك خطر كمتري براي قسمتهاي فلزي سيستم دارد. در اثر يونيزه شدن كامل اسيدسولفوريك به ازاي هر مولكول آن، دو يون هيدروژن آزاد ميشود. همچنين جزء آنيوني اسيد، يون سولفات (SO4-2) كه دو ظرفيتي است به خوبي توسط غشا دورريز ميشود. بنابراين، تزريق اسيد در كيفيت آب محصول تغيير قابل ملاحظهاي ايجاد نميكند.
حمل اسيدسولفوريك، خطرناك و نيز تماس آن با مواد آلي بسيار مضرّ است. (نظير چرم و اكثر لباسها) در بعضي از منابع آب، مقدار سولفات اضافه حاصل از تزريق اسيدسولفوريك ميتواند موجب افزايش پتانسيل رسوبدهي آن شود. حلاليت سولفات كلسيم، سولفات استرانسيوم و سولفات باريم، در آب محدود است و با كاهش pH ، حلاليت آنها افزايش مييابد. بنابراين، تزريق اسيد در كاهش پتانسيل تشكيل رسوب مؤثر است.
بعضي اوقات، اسيدكلريدريك، به جاي اسيدسولفوريك مورد استفاده قرار ميگيرد. اين اسيد، معمولاً گرانتر است و براي قسمتهايي از سيستم كه از جنس فولاد زنگنزن است خطرسازتر ميشود. به هرحال اين اسيد موجب افزايش پتانسيل تشكيل رسوب سولفات نميشود. جزء يوني كلرايد (CL-) به خوبي يون سولفات، توسط غشا جدا نميشود. اگر در سيستم RO ، جهت كنترل pH ، اسيد كلريدريك، جايگزين اسيد سولفوريك شود، تغيير قابل ملاحظهاي در كاهش دفع نمك به وجود خواهد آمد.
در سيستم RO به منظور كنترل pH ، امكان استفاده از ساير اسيدها وجود دارد، اما اين اسيدها بسيار گرانتر از اسيد سولفوريك و اسيد كلريدريك هستند.
كلرزدايي از سطح غشاي پلي آميد جهت پیش تصفیه سیستم های اسمز معکوس RO
غشاهاي پلي آمید در سيستم اسمز معكوس، تحمل وجود كلر را ندارند و اگر هم داشته باشند، غلظت كلر بايد بسيار ناچيز باشد. بسته به ساير اجزاي موجود در آب خوراك، كلر حتي با غلظت ناچيز ميتواند موجب شكستن پلي آميد شود. وجود آهن، مس، يا ساير عناصر انتقالي به عنوان كاتاليست عمل كرده، ميتوانند موجب افزايش نقش اكسيد كنندگي كلر شوند.
بعضي از كارخانههاي سازنده غشا، غلظت كلري را كه توسط المانهای غشاي پلي آميد قابل تحمل است، مشخص ميكنند. اين عدد برحسب ppm-hour (پيپي ام- ساعت) بيان ميشود و از حاصل ضرب غلظت كلر موجود در آب در تعداد ساعاتي كه غشا در تماس با كلر است، محاسبه ميشود. به عنوان مثال، چنانچه يك غشاي پلياَميد داراي تحمل ppm-hr1000 باشد، اين غشا قبل از اينكه آسيب جدي به آن وارد شود، توانايي عبور آب خوراك با غلظت 0.1 ppmكلر را به مدت ده هزار ساعت دارا ميباشد. در واقع، اين ميزان مقاومت (تحمل غشا در برابر كلر آزاد) وابستگي زيادي به آب خوراك دارد. از آنجایی که هم اکنون جنس اکثر ممبران ها پلی آمید می باشد، لذا باید غلظت كلر آزاد در آب، بسيار ناچيز باشد.
اكنون در بسياري از آبهاي شهري از كلرآمين به عنوان بايوسايد در سيستم آب شهري استفاده ميكنند. كلرآمين نسبت به كلر آزاد، فعاليت كمتري دارد بنابراين، پايدارتر است. مزيت كلرآمين بركلر آزاد اين است كه با مواد آلي در آب واكنش نميدهد و در نتيجه، تريهالومتان (THMS) كه يك ماده سرطانزا است، تشكل نميشود.
كلرآمين در غلظتهاي پايين با غشاي پلي آميد سازگار است با اين تفاصيل، وجود كلر در منابع آب ميتواند موجب خرابي غشاي پلي آميد شود. در سيستمهاي آب شهري يكي از روشهاي توليد كلرآمين، واكنش آمونياك با كلر آزاد است. وجود كلر آزاد همراه با كلرآمين در بعضي مواقع ميتواند موجب خرابي غشاي پليآميد شود بنابراين، تقريباً هميشه لازم است كه توسط كارخانههاي سازنده غشا، سيستم پيش تصفيه شامل مرحله كلر زدايي يا حذف كلرآمين براي آب شهري درنظر گرفته شود.
pH>5:
HOCl + NH3 → NH2Cl + H2O
با عبور آب از ميان كربن فعال شده يا توسط تزريق صحيح مواد شيميايي احيا كننده، ميتوان عامل اكسيد كننده را حذف كرد. عوامل احيا كننده نظير سولفيت سديم (Na2So3) . بيسولفيت سديم (NaHSO3) و متابي سولفيت سديم (Na2S2O5) براي اين منظور مورد استفاده قرار ميگيرند. تزريق اين مواد بايد به اندازهاي باشد كه بعد از حذف كامل عامل اكسيد كننده، عامل احيا كننده به اندازه 1 ppm به صورت اضافي در سيستم باقي بماند. واكنش اين مواد با اسيد هيپوكلرو در زير نوشته شده است.
سولفيت سديم:HOCL + Na2SO3 → HCL + Na2SO4
بيسولفيت سديم : HOCL + NaHSO3 → Na CL + H2SO4
متابي سولفيت سديم : 2HOCL + Na2S2O5 + H2O → 2 NaCL + 2H2SO4
تيوسولفات سديم با كلر آزاد چندين واكنش مختلف ميدهد كه بستگي به pH دارد.
بيسولفيت سديم و متابي سولفيت سديم دو عامل احيا كننده هستند كه به طور معمول در سيستمهاي پيش تصفيه سیستم اسمز معکوس RO مورد استفاده قرار ميگيرند. بي سولفيت سديم به صورت محلول، قابل تهيه است، در حالي كه متابيسولفيت سديم به صورت كريستال تهيه ميشود. گازهاي حاصل از مخلوط كردن متابيسولفيت سديم با آب ، سوزش آور و آزاردهنده است.
حذف عوامل اكسيدكننده در سيستمهاي پلي آميد از اهميت خاصي برخوردار است، دو پمپ و دو تانك مجزا براي تزريق عامل احيا كننده پيشنهاد ميشود. اگر يك تانك، خالي و يا پمپ دچار مشكل شد، سريعاً از پمپ و تانك ديگر براي محافظت از غشاي پلياَميد استفاده ميشود.
استفاده از دستگاه اندازهگير ORP (Oxidation Reduction Potential) ، يكي ديگر از روشهايي است كه براي اطمينان از تزريق كافي عامل احيا كننده و عدم وجود عوامل اكسيدكننده مورد استفاده قرار ميگيرد.اين دستگاه، قادر به اندازهگيري ميزان اكسيدشوندگي يا احياكنندگي آب است. ORP بايد به سيستم كنترلي آژير و توقف واحد مجهز شود. براي اطمينان از عدم وجود عامل اكسيد كننده در آب، ORP بايد كمتر از 175 ميليولت باشد.
در محيطهايي كه آب، خاصيت احيا كنندگي دارد، باكتريهاي بيهوازي تكثير ميشوند. اگر ORP در محدوده -100 mv تا -200 mv باشد يون سولفات، احيا شده و به سولفيد هيدروژن (H2S) تبديل ميشود. اگر ORP، پايينتر از 100 mv نگهداشته شود از فعاليت اين نوع باكتريهاي بيهوازي جلوگيري شود.
نسبت غلظت وزني براي واكنش كامل با كلر آزاد براي هريك از عوامل احيا كننده قبلي در زير نوشته شده است.

جلوگيری از تشكيل رسوب بمنظور پیش تصفیه سیستم های اسمز معکوس RO
در اثر عبور آب خام از غشا، آب دور ريزRO Concentrate با غلظت زياد (كه قادر به عبور از غشا نيست) در پشت غشا باقي ميماند. همزمان با عبور آب از ميان هر المان، غلظت املاح آب تغليظ شده در غشا افزايش مييابد و با انجام اين كار، امكان دارد كه غلظت بعضي از نمكهاي حل شده به حد حلاليتشان برسد و رسوب تشكيل شود. اگر نمكها بر روي سطح غشا رسوب كنند، كارآيي غشا تحت تأثير قرار ميگيرد.
تشكيل بيش از حد رسوب ميتواند موجب خرابي غشا شود. جلوگيري از تشكيل رسوب يا شستشوي شيميايي صحيح جهت رسوبزدايي پيش نياز بهرهبرداري موفق از سيستمهاي RO است.
نمكهاي حل شده حتي به مقدار كم، تمايل به رسوب دهي بر روي غشا دارند. آناليز كامل شيميايي، غلظت يونها را مشخص ميكند. با اين اطلاعات، پتانسيل رسوب هر نمك محلول تعيين ميشود.
محاسبه پتانسيل تشكيل رسوب بمنظور پیش تصفیه سیستم های اسمز معکوس RO
نمكها در اثر يونيزه شدن در آب به اجزاي آنيوني و كاتيونيشان تبديل ميشوند. اگر غلظت كاتيون هاي نمك و غلظت آنيونهاي مشترك به حد حلاليت آن نمك برسد، امكان تشكيل كريستال در اثر رسوبدهي وجود دارد. اين كار در سيستم اسمز معکوس RO كه نمكها در سيستم تغليظ شدهاند، به راحتي اتفاق ميافتد.
هر نمك، مشخصات مربوط به خودش را دارد و اين مشخصات به طور جدي در پتانسيل رسوبدهي آن نمك تأثير ميگذارد. بعضي از نمكها نسبت به بعضي ديگر، زودتر رسوب ميكنند. بعضي از نمكهاي تهنشين شده، راحتتر از ديگر نمكها، قابل تميز شدن هستند. معمولاً ترجيح داده ميشود كه از تشكيل هر نمكي بر روي غشا جلوگيري شود، زيرا به اين طريق ديگر نيازي به رسوبزدايي سطح غشا نخواهد بود.
حلاليت يك نمك به غلظت اجزاي تشكيل دهنده آن نمك، pH آب، دما و غلظت ساير نمكها در محلول بستگي دارد، روشهاي مختلفي وجود دارد تا حلاليت هر نمك به طور جداگانه مشخص شود. pH آب، دما و منابع آب جبراني موجب تغيير در حلاليت نمكهاي مخصوص ميشوند.
هنگام محاسبه پتانسيل رسوب دهي يك نمونه آب ، پيشنهاد ميشود كه حلاليت تمام نمكهاي محلول، در جريان تغليظ شده RO محاسبه شود. اگر مقدار به دست آمده، بيش از حلاليت نمك باشد، بايد راههاي مختلف براي كنترل رسوبدهي آنها در نظر گرفته شود. در زير، انواع نمك هايي كه اغلب در منابع آب وجود دارند نوشته شدهاند. نمكهاي حل شده در منابع آب طبيعي عبارتند از:

فلزاتي نظير آهن فريك (Fe3) ، منگنز (Mn3) يا آلومينيم (Al+3) مشمول ليست قبلي نميشوند، زيرا در تمام حالات، نمكهايشان غير محلول است. اگر يكي از اين يونهاي فلزي در آب اسمز معکوس RO وجود داشته باشد، نمكهاي آن بايد توسط فيلتر حذف شود تا از تهنشيني آنها برروي المانهای غشا جلوگيري شود.
محاسبه غلظت نمك در آب تغليظ شده RO بمنظور پیش تصفیه سیستم های اسمز معکوس
وقتي كه غلظت نمكها در حدّ اشباع باشد، بيشترين پتانسيل براي تشكيل رسوب در آب تغليظ شده RO وجود دارد. كل جامدات محلول (TDS) در آب تغليظ شده علاوه بر مجموع غلظت تمام يونها، با توجه به بازدهي سيستم از طريق زير قابل محاسبه است.
(بازدهي – 1) ÷ 1 = ضريب تغليظ
در واقع ، غلظت نمكها در سطح غشا در مثال قبلي ممكن است بيش از 4 برابر غلظت آب دور ريز باشد. در حالي كه آب خالص از غشاي RO عبور ميكند، غلظت املاح آب دور ريز افزايش پيدا ميكند. اين پديده، پلاريزاسيون غلظت ناميده ميشود. اين پارامتربه گراديان غلظت در سطح غشا اطلاق ميشود.
ميزان پلاريزاسيون غلظت در سطح غشا بستگي به تلاطم تودهي جريان و توانايي آن تلاطم در اعمال نيروي تنشي بر نمكها دارد. محاسبات انجام شده براي يك المنت استاندارد (تميز)، مشخص ميكند كه غلظت نمكها در سطح غشا در مقايسه با تودهي جريان به ميزان 13 تا 20% بيشتر است. هنگام محاسبه پتانسيل رسوب، پلاريزاسيون بايد در نظر گرفته شود (سيستمهاي سيال در مقالات مربوط به كارآيي غشا، ضريب پلاريزاسيون غلظت را 13% و هايدراناتيك آن را 20% در نظر ميگيرند) ضريب غلظت طبق رابطهي زير نوشته ميشود.
(بازدهي – 1) ÷ پلاريزاسيون = ضريب غلظت

تصویر- پلاريزاسيون غلظت
بررسی كربنات كلسيم بمنظور پیش تصفیه سیستم های اسمز معکوس
بيكربنات (HCO3-) در اكثر منابع آب طبيعي وجود دارد. به خاطر توانايي آب در حل كردن كربنات كلسيم از زمين (كه در نتيجه آن يون بيكربنات توليد ميشود) يا جذب CO2 از هوا (كه قابل تبديل به بيكربنات در آب است)، منابع آب طبيعي از لحاظ بيكربنات محلول، در حد اشباع هستند در نتيجه در سيستم اسمز معکوس RO به محض اينكه آب تغليظ شد، كربنات كلسيم يكي از اولين نمكهايي است كه رسوب ميكند.
شاخص اشباع لنجلير در طراحی پیش تصفیه سیستم های اسمز معکوس
شاخص اشباع لانژلیر (LSI) یک اصطلاح مهم در شیمی آب است. LSI شاخص سنجش توانایی محلول در حل یا رسوب کربنات کلسیم است، که اغلب به عنوان شاخص خوردگی آب استفاده می شود. این شاخص جهت سنجش توانایی آب برای خوردگی یا مقیاس گذاری در مبدل حرارتی یا در نقاطی که از آب به عنوان وسیله انتقال حرارت در مبدل حرارتی استفاده می شود ، کاربرد دارد.
پتانسيل رسوبدهي كربنات كلسيم با استفاده از ضريب اشباع لانژلیر یا لنجلير LSI (Langelier Saturation Index) قابل محاسبه است.
LSI نشانگر تفاوت بین pH واقعی سیستم و pH در حالت اشباع می باشد:
LSI = pH – pHs
برای LSI> 0 ، آب بسیار اشباع میباشد و تمایل به رسوب گذاری CaCO3 دارد.
برای LSI = 0 ، آب توسط CaCO3 در حال تعادل است و نه رسوب می کند و نه حل می شود.
برای LSI <0 ، آب تحت اشباع است و تمایل به حل شدن CaCO3 جامد دارد.


در فرمول LSI = PH – PHs
pHs عبارت از pH آب در حالتي است كه از كربنات كلسيم اشباع شده است و طبق رابطهي زير محاسبه ميشود.
pHs = (9.3 + A + B) – (C + D)
A = (log [TDS] – 1)/10
B= -13.12 Log10 (0C + 273) + 34.55
C = log10 [Ca+2 as Caco3] -0.4
D = Log10 [Alkalinity as CaCo3]
مقادير داخل كروشه برحسب غلظت مولي (moles/lit) است، به جز TDS كه برحسب (mg/lit) بيان ميشود. (توجه : مقادير A,B,C از شكل نيز قابل محاسبه است.) اگر ضريب لنجلير منفي باشد، نشان دهنده آن است كه آب، تمايلي به رسوب دهي ندارد. هرقدر ضريب لنجلير، عدد مثبت بزرگتري باشد پتانسيل رسوبدهي افزايش مييابد. با استفاده از ضريب لنجلير ميتوان حد مجاز غلظت نمكهاي آب تغليظ شده را (قبل از اينكه رسوبي تشكيل شود) محاسبه كرد. همچنين از ضريب لنجلير ميتوان در تعيين نياز به تزريق يك بازدارنده رسوب، استفاده كرد. از ضريب لنجلير براي تعيين قابليت خوردگي آب نيز ميتوان استفاده كرد. (به عنوان مثال، هرچقدر ضريب لنجلير منفيتر شود، قابليت خورندگي آب بيشتر ميشود.) pH آب تغليظ شده اسمز معکوس RO ، تابعي از قلياييت و غلظت CO2 در آن است؛ براي محاسبه pH در آب تغليظ شده، ابتدا لازم است غلظت CO2 در آب خوراك محاسبه شود. به خاطر اينكه گازهاي محلول نظير CO2 به راحتي از غشا اسمز معکوس RO عبور ميكنند، غلظت گاز در آب تغليظ شده با غلظت آن در آب خوراك، يكسان است. pH اشباع با استفاده از غلظت CO2 و قلياييت آب تغليظ شده قابل محاسبه است رابطهي بين pH و نسبت قلياييت به CO2 در شكل زیر نشان داده شده است و توسط فرمول زير قابل محاسبه است.
pH = 6.3 + Log10{[Alkalinity as CaCO3]/[CO2]}

شكل – مقادير شاخص لنجلير
براي تعيين غلظت CO2 در آب خوراك، رابطه بالا را ميتوان طبق فرمول زير بيان كرد.
PH-6.3) = [Alkalinity as CaCO3] ÷ [CO2] [CO2] = [Alkalinity as CaCO3] ÷ 10(PH-6.3)
در pH هاي بالاتر از 3/8 ، غلظت CO2 محلول، ناچيز است. در pH بالا يون كربنات از بيكربنات تشكيل ميشود. نسبت بين غلظت بيكربنات (قلياييت متيل اورانژ) و غلظت كربنات (قلياييت فنل فنالين)، تابعي از pH است كه در شكل نشان داده شده است.

شكل – رابطه بين قلياييت بيكربنات، دياكسيد كربن و PH

شكل – تأثير كربنات و قلياييت بيكربنات بر pH
مقدار مثبت ضريب لنجلير، معرف اين است كه كربنات كلسيم در آب تغليظ شده اسمز معکوس RO رسوب ميكند. به خاطر اينكه pH ، يك مقياس لگاريتمي است، مقدار بيش از 1+ شاخص لنجلير، حاكي از رسوب بسيار زياد برروي غشا خواهد بود. تا زماني كه اقدامات لازم جهت كنترل يا جلوگيري از رسوب انجام نشود، احتمال تشكيل رسوب بر روي المنتهاي غشاي انتهايي سيستم اسمز معکوس RO وجود دارد. (المنتهايي كه آب خوراك آنها، آب دور ريز مراحل قبلي است).
شاخص پايداري استيف و ديويس در طراحی پیش تصفیه سیستم های اسمز معکوس
ضريب لنجلير یا لانژلیه دقت زيادي در نشان دادن حلاليت كربنات كلسيم براي آبهايي كه غلظت املاح آنها به mg/l4000 ميرسد، ندارد. رابطهي استيف و ديويس، اصلاح شده رابطهي لنجلير است كه براي آب با مقادير TDS بالا در نظر گرفته شده است. در اين رابطه از مقادير تجربي استفاده ميشود و طبق فرمول زير محاسبه ميشود.
ضريب پايداري استيف و ديويس= pH – Pca – PAl – K
به طوري كه:
Pca : منفي لگاريتم غلظت كلسيم است. (برحسب مولاريته بيان ميشود.)
PAl : منفي لگاريتم غلظت قلياييت محلول است. (برحسب مولاريته بيان ميشود.)
K : ثابتي است كه مقدار آن با دما و قدرت يوني آب بستگي دارد. (غلظت يوني به غلظت كلي نمك اطلاق ميشود.)
اين مقادير با استفاده از تصاویر قابل محاسبه است مانند ضريب لنجلير یا لانژلیه، مثبت بودن ضريب استيف و ديويس معرف رسوبدهي كربنات كلسيم و منفي بودن ضريب نشانهي خوردگي است.

شكل- مقادير K در قدرت يوني مختلف و ضرايب لازم براي تبديل آناليز آب به قدرت يوني
جلوگيري از رسوب كربنات كلسيم در طراحی پیش تصفیه سیستم های اسمز معکوس
جلوگيري از تشكيل كربنات كلسيم مورد توجه بوده و معمولاً براي سيستم مورد نياز است. در اكثر سيستمهاي كوچك اسمز معکوس RO ، براي جلوگيري از رسوب كربنات كلسيم، بازدهي سيستم را كاهش ميدهند. در صنايع بزرگ، به خاطر اقتصادي بودن سيستم، بازدهي بايد بالا باشد. راههاي جلوگيري از رسوب كربنات كلسيم در بازدهي بالا در زير بيان شدهاند:
1) به آب خوراك، اسيد تزريق شود تا اكثر بيكربنات به دياكسيد كربن تبديل شود و همچنين به خاطر پايين بودن pH ، حلاليت كربنات كلسيم افزايش مييابد.
2) به آب خوراك، بازدارنده رسوب تزريق شود تا امكان تشكيل رسوب كاهش يابد.
ير سختي آب خوراك گرفته شود، اين كار توسط رزينهاي كاتيوني ضعيف از نوع سديم در سختيگير صورت ميگيرد.
حلاليت سيليس در طراحی پیش تصفیه سیستم های اسمز معکوس
در PH پايينتر از 8 ، سيليس محلول به صورت اسيد سيليسك ميباشد. Si(OH)4 بصورت H4(SiO)4 بيان ميشود. اگر حلاليت اسيد سيليسك به حدّ اشباع برسد، سيليس طبق واكنش زير رسوب ميكند.
Si(OH)4 →2H2O + SiO2
ثابت حاصل ضرب حلاليت براي سيليس در حالت اشباع بصورت زير است:
KSP = [Si(OH)4] به طوري كه:
Si(OH)4][ ، غلظت اسيد سيليسك است كه برحسب SiO2 بيان ميشود و واحد آن mg/l ليتر است. در C°25 و pH خنثي، ثابت حاصل ضرب حلاليت براي سيليس حدود mg/l96 است (برحسب SiO2). اگر غلظت اسيد سيليسك بيش از mg/l96 باشد، امكان رسوب سيليس وجود دارد، بهرحال سيليس به صورت آهسته تبديل به كريستال ميشود. اكثر سيستمهاي اسمز معکوس RO با اطمينان در سرويس قرار ميگيرند، در صورتي كه غلظت اسيد سيليسك در آب دور ريز آنها mg/l140 است و تاكنون هيچگونه گزارشي مبني بر تشكيل اين رسوب مشاهده نشده است.
حلاليت سيليس تابع شديدي از دما ميباشد. در دماي نزديك به انجماد (0F32) ، سيليس نامحلول است. تأثير دما بر حلاليت سيليس، را ميتوان بصورت يك رابطهي خطي رسم كرد. در يك دماي مشخص ميتوان حاصل ضرب حلاليت را با استفاده از شكل، مشخص كرد. خط چين در اين شكل، نشان ميدهد كه حتي با وجود زيادتر بودن غلظت سيليس از ميزان تئوري (به ميزان جزئي)، بازهم ميتوان سيستم را در سرويس قرار داد.
حلاليت سيليس با افزايش و كاهش pH ، افزايش مييابد. تزريق اسيد، يكي از راههاي افزايش حلاليت سيليس است. حلاليت سيليس، تابعي از pH است.
اگر pH آب به بيش از 8 افزايش يابد، اسيد سيليسك به آنيون سيليكات تجزيه ميشود. اين افزايش حلاليت تا زماني است كه غلظت ساير كاتيونهاي چند ظرفيتي در حدّ قابل توجهي باشد. اين كاتيونها ميتوانند موجب تشكيل نمكهاي سيليكات نامحلول در pH بالاتر شوند.
در pH بالاتر از 8 ، وجود آهن با آلومينيوم ممكن است موجب رسوب سيليكات نامحلول شوند. همچنين، ساير كاتيونهاي چند ظرفيتي تمايل دارند با سيليكات در pH مشخصي بيشتر از 8 رسوب كنند. اين رسوب در يك pH مشخص اتفاق ميافتد كه نسبت به pH محلول هيدروكسيد كه به حالت اشباع رسيده است، بين 1 تا 2 واحد كمتر است.

شكل – تأثير دما بر حلاليت SiO2
حلاليتهاي هيدروكسيد كاتيون هاي چند ظرفيتي به طور كامل مشخص شده است. رسوب هيدروكسيد معمولاً در صنايع تصفيه فاضلاب به عنوان يك روش براي جداسازي فلزات از آب مورد استفاده قرار ميگيرد. نمودارهاي حلاليت در شكل با كاهش pH به ميزان 2 واحد نشان شدهاند. قسمتهاي هاشورزده، مشخص كننده غلظت كاتيون در يك pH است، به طوري كه ممكن است تشكيل رسوب شروع شود. همچنين از اين نمودار ميتوان براي محاسبه حلاليت سيليكات براي بهرهبرداري از سيستم در pH بالا استفاده كرد. از آنجايي كه pH آب دورريز يك واحد بيش از pH آب خوراك است، حلاليت سيليس براي سيستمهايي كه آب خوراك آنها بيش از 5/7 است، بسيار حائز اهميت است.
ذرات سيليس، نظير آنچه كه در اكثر خاكهاي رس وجود دارد، ممكن است در pH پايين در حضور كاتيونهاي باردار قوي نظير آلومينيوم يا آهن منعقد شود. آهن يا آلومينيوم ممكن است از بقاياي سيستمهاي تصفيه شهري به صورت اضافه باقي بمانند.

شكل. ضريب تصحيح PH سيليس SiO2
تزريق اسيد جهت پیش تصفیه سیستم های اسمز معکوس
مؤثرترين راه براي جلوگيري از تشكيل رسوب كربنات كلسيم، كاهش pH آب توسط تزريق اسيد است. اسيد طبق واكنش زير، يون بيكربنات را به دياكسيد كربن تبديل ميكند.
2NaHCO3 + H2SO4 ↔ CO2 + 2H2O + Na2SO4
بيكربنات، عامل توليد يون كربنات در تشكيل نمك كربنات كلسيم است، بنابراين حلاليت كربنات كلسيم، وابستگي زيادي به غلظت يون بيكربنات دارد. حلاليت كربنات كلسيم به pH آب بستگي دارد. تزريق اسيد به آب خوراك سیستم اسمز معکوس RO به ميزان كافي موجب كاهش يون بيكربنات ميشود كه در نتيجه از تشكيل كربنات كلسيم جلوگيري به عمل ميآيد. در ضمن تزريق اسيد موجب كاهش pH ميشود، كه در نتيجه حلاليت كربنات كلسيم افزايش مييابد.

شكل. غلظت فلز در محدودهاي كه رسوب سيليكات اتفاق ميافتد.
يكي از نتايج ديگر استفاده از تزريق اسيد، به منظور جلوگيري از تشكيل كربنات كلسيم اين است كه غلظت اسيد به ميزان كافي موجب حل شدن مجدد رسوبهاي كربنات كلسيمي ميشود كه قبلاً در محلول وجود داشته است. اگر سيستم تزريق دچار مشكل شود، نتيجه آن، تشكيل رسوب كربنات كلسيم است و همين كه تزريق اسيد مجدداً در سيستم برقرار شد رسوب به صورت محلول در ميآيد. به هرحال، اين عمل مربوط به حالتي نميشود كه اگر رسوب كربنات به مدت طولاني در سيستم اسمز معکوس RO وجود داشته باشد تا رسوب و تهنشيني رسوب سيليس يا سولفات را تسريع نمايد.
همچنان كه در بخش قبل توضيح داده شد، تزريق اسيد در اكثر سيستمهاي اسمز معکوس RO از نوع سلولز استات، جهت كاهش سرعت هيدروليز غشا لازم است. بنابراين، اولين هدف از تزريق اسيد، جلوگيري از تشكيل رسوب كربنات كلسيم در سيستمهاي سلولز استات است.
وقتي كه تزريق اسيد به سيستم اسمز معکوس RO قطع شود، دياكسيد كربن فوقاشباع، تمايل دارد كه از آب جدا شود. همين كه اين عمل اتفاق افتاد، pH آب افزايش مييابد. در المنتهاي انتهايي سيستم كه غلظت نمكها در حداكثر مقدار است ممكن است افزايش pH به حدي باشد كه كربنات كلسيم رسوب كند.
همين كه سيستم تزريق اسيد در سرويس قرار گيرد، كربنات كلسيم به صورت محلول در ميآيد و pH كاهش مييابد. به هرحال، اگر تزريق اسيد به سيستم اسمز معکوس RO قطع شود، وجود كربنات كلسيم برروي سطح غشاهاي اسمز معکوس RO ميتواند موجب افزايش سرعت هيدروليز غشاي سلولز استات شود. اين عمل، عمر المنتهاي انتهايي را تحت تأثير قرار ميدهد.
براي سيستمهاي سلولز استات (كه به منظور جلوگيري از رسوبدهي كربنات كلسيم فقط از تزريق اسيد استفاده ميشود) پيشنهاد ميشود كه اسيد اضافي به آب خوراك تزريق شود. به عبارت ديگر، pH آب خوراك به اندازهاي كاهش داده شود كه ضريب لنجلير، برابر صفر شود. تزريق ممانعت كنندهي رسوب به مقدار بسيار كم به آب خوراك اسيدي، موجب كاهش عمل تهنشيني ميشود.
تزريق اسيد ميتواند موجب انعقاد جامدات شود. بنابراين، پيشنهاد ميشود كه محل تزريق اسيد، در آبهايي كه غلظت جامدات معلق آنها زياد است، در بالادست فيلترهاي مياني باشد. اسيد نبايد خطري براي لولهها و مواد ساختماني فيلترهاي مياني داشته باشد.
اولين نتيجه ناخوشايند تزريق اسيد، تشكيل CO2 است. در بسياري از صنايع، CO2 فوق اشباع كه به راحتي از غشا عبور ميكند به منزله آلودگي براي آب است و موجب افزايش فشار كاري بر روي رزينهاي تعويض يوني كه در پايين دست قرار دارند، ميشود.
محاسبه تزريق اسيد براي تنظيم PH جهت پیش تصفیه سیستم های اسمز معکوس
يك راه تجربي در استفاده از تزريق اسيد براي جلوگيري از تشكيل رسوب اين است كه pH آب خوراك تا 6 كاهش يابد. اين كار موجب ميشود كه حدود 80% غلظت بيكربنات كاهش يابد. براي اكثر منابع آب و مخصوصاً بازدهيهاي آب محصول اسمز معکوس RO، كاهش 80% درصدي غلظت بيكربنات، براي جلوگيري از رسوب كربنات كلسيم كفايت ميكند. اين گفته براي مواردي كه غلظت سختي و يا غلظت قلياييت بعضي از منابع آب زياد است و يا بازدهي سيستم اسمز معکوس RO بيش از 75% است، صدق نميكند.
شاخص لنجليریا لانژلیه در تشخيص pH مناسب آب خوراك براي جلوگيري از تشكيل كربنات، مفيد است.
براي محاسبه اسيد مورد نياز جهت كاهش pH آب تا ميزان مورد نياز، مقدار يون بيكربنات تبديل شده به دياكسيد كربن براي رسيدن به pH پايينتر، بايد محاسبه شود. با استفاده از نسبت بيكربنات به دياكسيد كربن داده شده برحسب تابعي از pH در شكل ، غلظت دياكسيد كربن در آب خوراك قبل از اينكه اسيد تزريق شود بايد مشخص گردد. همچنين اين نسبت از فرمول زير محاسبه ميشود.
[CO2] = [HCO3-] ÷ 10(PH-6.3)
به طوري كه:[HCO3-] برحسب CaCO3 بيان ميشود و واحد آن mg/L است. و [CO2] برحسب يون است و واحد آن mg/L است.
غلظت دي اكسيد كربن در آب خوراك با ضرب كرن در ضريب تبديلش برحسب CaCO3 بيان ميشود. اين ضريب، 14/1 ميباشد. سپس به قلياييت ورودي اضافه ميشود تا غلظت «اكسيدهاي كربن» تركيبي بدست آيد.
14/1 [HCO3-] + [CO2] ×=كل اكسيدهاي كربن
به طوري كه:
كل اكسيدهاي كربن، يك مقدار نسبي براي غلظت كلي قلياييت و اكسيدهاي كربن برحسب CaCO3 است.
به جاي [CO2] در معادله قبلي، ميتوان معادل آن را قرار داد.
14/1 [HCO3-] +[HCO3-] ÷10(PH-6.3) ×=كل اكسيدهاي كربن
( ÷ 10 (PH-6.3)14/1+1( كل اكسيدهاي كربن = [HCO3-] اختلاف در غلظت بيكربنات نسبت به غلظت قبلياش (برحسب CaCO3 ) برابر با غلظت اسيد تزريق شده است (برحسب CaCO3 ) . تمام اطلاعات مورد نياز براي محاسبه شاخص لنجلير (براي اينكه مشخص شود كه كربنات كلسيم به طور كامل در pH مطلوب محلول است) دردسترس ميباشد.
تعليق و جلوگيري از رسوب جهت پیش تصفیه سیستم های اسمز معکوس
اگر غلظت يك نمك به حد حلاليتش برسد، شروع به رسوبدهي ميكند. در اين حالت، تشكيل كريستالها شروع ميشود كه موجب تسريع در تشكيل كريستالهاي ديگر نمك در سطح كريستال ميشود. اين كريستالهاي نمك به شرط اينكه به اندازه و جرم حجمي لازم برسند از حالت معلق خارج ميشوند و شروع به رسوبدهي ميكنند. فرآيند تهنشيني رسوب تا زماني ادامه خواهد داشت كه يونها در محلول به محدودهي حلاليتشان برسند.
بازدارندههاي رسوب در جلوگيري از گرفتگي غشا براثر رسوب دهي بسيار مؤثرند. اين بازدارندهها با جلوگيري از رشد كريستال نمك، سرعت فرآيند ته نشيني را كاهش ميدهند. اين مواد در سطح كريستال نمك تشكيل شده، جذب شده و با جلوگيري از جذب بيشتر نمك فوق اشباع در سطوح كريستال، سرعت گسترش كريستال نمك را كاهش ميدهند. كريستالها هرگز به اندازه و يا غلظت كافي جهت خارج شدن از حالت معلق، نميرسند. فرآيند ته نشيني رسوب تا زماني كه غلظت يونهاي خارج شده از محلول به محدودهي حلاليتشان برسد، ادامه مييابد.
اكثر بازدارندههاي رسوب، داراي چندين خاصيت پراكنده سازي رسوب هستند كه به نوع ممانعت كننده بستگي دارد. اين بازدارندهها با جلوگيري از رشد كريستالهاي نمك، فرآيند ترسيب را كاهش ميدهند. پراكنده سازي نيز در اثر محاصرهي ذرات معلق نمك، آهن يا مواد جامد آلي به وسيله بازدارنده رسوب انجام ميشود. اين مواد پراكنده ساز، داراي بار منفي بوده، تمايل به دفع ساير ذرات باردار محاصره شدهي مشابه را دارند. بازدارنده، موجب جلوگيري از تراكم ذرات و تشكيل ذرات بزرگتر كه به هر نحوي امكان خارج شدن آنها از حالت معلق وجود دارد ميشود.
بازدارندههاي رسوب فقط در كاهش فرآيند تشكيل رسوب يا كاهش فرآيند و تراكم ذرات رسوب مؤثرند. در سيستم اسمز معکوس RO به اين دليل كه نمكها از طريق جريان تغليظ شده از سيستم خارج ميشوند، اين نوع بازدارندهها ترجيح داده ميشوند.
كاهش بازدهي غشا در اثر تشكيل رسوب، همانند گرفتگي توسط جامدات معلق و يا فعاليت بيولوژيكي نيست، زيرا در اين مورد خاص با پيش تصفيه صحيحِ آب خوراك، ميتوان تشكيل رسوب را به آساني كنترل يا حذف كرد. اما در صورتي كه ترسيب اتفاق اُفتد، بسته به نوع غشا، رسوب و مقدار آن، كاهش بازدهي فرق ميكند.
بسياري از سيستمهاي اسمز معکوس RO ، با تزريق اسيد به جريان آب خوراك و يا به وسيله چرخش يك محلول اسيدي تميز كننده، به راحتي كربنات كلسيم را از سطح غشا تميز ميكنند. در بعضي از سيستمهاي اسمز معکوس RO از نوع پلي اميد حلزوني، از تزريق بازدارنده رسوب به عنوان يك روش جلوگيري از تشكيل كربنات كلسيم استفاده ميشود.
بهره برداري از سيستمهاي غشاي سلولز استات كه جلوگيري از تشكيل رسوب در آنها، حداقل است، توصيه نميشود، زيرا با تشكيل رسوب، pH قسمتهايي از سطح غشا افزايش مييابد كه اين مسئله موجب افزايش سرعت هيدروليز سلولز استات ميشود. اين سيستمها بعد از چند روز بهرهبرداري، به دليل وجود مقدار زيادي رسوب بر روي غشا، قدرت دفع اوليه نمك را از دست ميدهند.
محل تزريق اسید و آنتی اسکالانت در پیش تصفیه سیستم های اسمز معکوس
زماني كه هم اسيد سولفوريك و هم بازدارنده رسوب با هم مورد استفاده قرار ميگيرند و حلاليت نمك سولفات به حد اشباع ميرسد، محل تزريق بازدارندهي رسوب بايد قبل از نقطه تزريق اسيد باشد. به عبارت ديگر، ممكن است قبل از اينكه بازدارندهي رسوب فرصتي براي كاهش رسوب دهي داشته باشد، سولفات، رسوب كند. غلظت زياد يون سولفات در محل تزريق اسيد موجب ايجاد هسته كريستالي يون سولفات ميشود، مگر اينكه به منظور كاهش رسوب دهي، بازدارنده رسوب، تزريق شود.
تزريق بيش از حد آنتی اسکالانت (بازدارنده رسوب) در پیش تصفیه سیستم های اسمز معکوس
اگر بازدارنده زياد تزريق شود، امكان رسيدن غلظت آن به حد حلاليت كمپلكس كاتيون / بازدارنده زياد است. اگر اين مسئله اتفاق افتد، كمپلكس كاتيون / بازدارنده در سيستم غشا، از محلول خارج ميشود و در نتيجه، تأثيرش از بين ميرود. با استفاده از تركيبي از بازدارندههاي رسوب (كه بيشتر از يك نوع بازدارنده استفاده ميشود)، پتانسيل تشكيل رسوب را ميتوان تا حد ممكن كاهش داد. تأثير بازدارندهها بر يكديگر در جهت افزايش خاصيت بازدارندگي است، با اين حال، احتمال كمتري وجود دارد كه يك بازدارنده موجب خارج شدن بازدارندههاي ديگر از محلول شود. در حقيقت، يك بازدارنده به محلول بودن ساير بازدارنده، كمك ميكند.