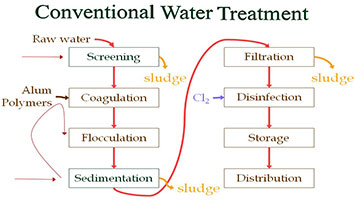
در این مقاله قصد داریم تا با بررسی فرایندهای تصفیه آب به افزایش اطلاعات شما دربارهی اینکه چگونه این فرایند بسیار مهم انجام میشود بپردازیم.
1- انعقاد و لخته سازی
آبهای طبیعی معمولاً حاوی مقادیر قابل توجهی جامدات محلول و معلق میباشند. مواد معلق بزرگ مانند ذرات ماسه، رفتار ذرات مجزا را داشته و به سرعت توسط تهنشینی و یا فیلتراسیون حذف میگردند. مواد معلق ریزتر به راحتی تهنشین نمیشوند. این مواد کلوئیدی بوده و فقط با تهنشینی و فیلتراسیون پس از آزمایش فیزیکی و شیمیایی قابل حذف میباشند.
آمایش شیمیایی مواد کلوئیدی به عنوان انعقاد شناخته میشود و شامل اضافهکردن مواد شیمیایی برای بهبود خواص فیزیکی مواد کلوئیدی و حذف آن ها میباشد. آمایش فیزیکی که به عنوان لختهسازی شناخته میشود، شامل به هم زدن آرام سیال برای سرعت بخشیدن به برخورد بین ذرهای و درنتیجه تجمع مواد کلوئیدی، تشکیل لخته و آمادهشدن برای تهنشینی است.
برخی مواد یا جامدات محلول معدنی موجود در آب نیز با آمایش شیمیایی یا فیزیکی به صورت مواد معلق درآمده و حذف میشوند. کلسیم و منیزیوم مثال هایی از این مواد معدنی هستند که به وسیله اضافهکردن آهک و سودا به صورت نامحلول درآمده و تولید رسوب معدنی مینمایند. رسوبات حاصله را میتوان با انعقاد، تهنشینی و فیلتراسیون متعارف حذف کرد. این فرآیند رسوبدهی نامیده میشود.

1-2- مواد معلق
جامدات معلق در آب شامل ماسه، خاک، مواد آلی، باکتریها، ویروسها و سایر ذرات میباشند. برخی از این ذرات در تصفیه آب ایجاد مزاحمت میکنند. جدول شماره 1 محدوده اندازه متداول ذرات موجود در آبهای سطحی را فهرست نموده است. ذرات ذرشتتر از یک میکرون معمولاً در آب های ساکن حذف میگردند. ذرات ریزتر به راحتی حذف نخواهند شد. سوسپانسیونی از ذرات که تهنشین نگردند به عنوان سوسپانسیون پایدار شناخته میشود. ذراتی که این چنین سوسپانسیونی را ایجاد میکنند، کلوئید نام دارند.

1-3- مشخصات کلوئیدها
ذرات کلوئیدی با اندازهشان مشخص میگردند. اندازه این ذرات معمولاً بین 001/0 تا 1 میکرون درنظرگرفته میشود. ذرات موجود در این محدوده اندازه شامل 1) ذرات غیر آلی مانند الیاف ویروسها، باکتریها و پلانکتونها میباشد. کلوئیدها دارای خاصیت افتراق نور آزبست ، رس و سیلت 2) رسوبات مواد منعقدکننده و 3) ذرات آلی مانند ترکیبات هیومیک3 ، ویروسها، باکتریها و پلانکتونها میباشد. کلوئیدها دارای خاصیت افتراق نور هستند، در حالی که محلولهای حقیقی به مقدار بسیار کمی دارای چنین خاصیتی هستند. خاصیت افتراق نور معمولاً با کدورت بیان میشود. محلولهای کلوئیدی براساس تمایل به جذب آب به دو دسته آبدوست3 و آبگریز4 تقسیم میگردند. رفتار انحصاری ذرات کلوئیدی مربوط به سطح آنها میباشد. در کلوئیدها نسبت سطح به جرم بسیار زیاد است. جرم آنها آنقدر کوچک است که نیروی ثقل تأثیر بسیار کمی روی رفتار آنها دارد. اصلیترین پدیدههایی که رفتار کلوئیدها را کنترل میکنند شامل نیروهای الکترواستاتیک، نیروهای واندروالس و حرکت براونی 5 میباشند.
1-4- نیروهای الکترواستاتیکی
نیروهای الکترواستاتیکی مهمترین نیروهای درگیر در پایداری سوسپانسیونهای کلوئیدی میباشند. اغلب کلوئیدها دارای بار الکتریکی هستند. طبیعت این بارها براساس طبیعت کلوئیدها متفاوت است. اکسیدهای فلزی عمدتاً دارای بار مثبت، در حالی که اکسیدهای غیرفلزی معمولاً دارای بار منفی هستند. سه فرآیند مهم که در ایجاد بار الکتریکی ذرات نقش دارند عبارتند از:
الف- گروههای سطحی جامدات میتوانند با آب واکنش داده و پروتون بدهند یا بگیرند. به طور مثال برای یک سطح اکسید مانند سیلیکا با گروههای سطحی سیلانول6 داریم:

یک سطح آلی میتواند دارای گروههای کربوکسیل7 یا آمینو8 باشد و به صورت زیر عمل نماید.
در این واکنشها بار سطحی ذرات جامد بستگی به غلظت پروتونها (H+) و یا پی- اچ محلول دارد. در صورتی که پی- اچ افزایش پیدا کند (یعنی غلظت H+ کاهش یابد) معادلات به سمت راست تمایل
یافته و بار سطحی به شدت منفی میگردد. سیلیکا در آب با پی- اچ بالاتر از دو دارای بار منفی است. پروتئینها که دارای مخلوطی از گروههای کربوکسیل و آمین هستند ممولاً در پی- اچ بالاتر از چهار دارای بار منفی میباشند.
ب- گروههای سطحی میتوانند در آب با سایر یونها واکنش دهند. مجدداً سیلیکا را مثال میزنیم:

ج- بار سطحی میتواند ناشی از نقص در ساختمان مولکولی ذره باشد که جابجایی ایزومورفیک نامیده میشود و عامل بخش عمده بار در رسهای معدنی میباشد. بار سطحی کلوئیدها یونهای دارای بار مخالف2 را جذب میکند. این یونها شامل هیدروژن و سایر کاتیونها یک لایه متراکم چسبیده به ذره کلوئیدی به نام لایه استرن3 ایجاد میکنند. مولکولهای آب نیز ممکن است جذب ذره کلوئیدی شوند این جذب به دلیل بار ناشی از نامتقارنبودن مولکولهای آب است. لایه دومی از یونها نیز که اصطلاحاً لایه انتشاری4 نامیده میشود، جذب سطح کلوئید میگردند. معمولاً به مجموع این دو لایه، لایه دوگانه5 اتلاق میگردد. در این لایه انتشاری مولکولهای آب نیز جذب شدهاند و در بخشی از این لایه پیوند مولکولهای آب به گونهای میباشد که لایهای به نام لایه برشی6 یا سطح برشی را ایجاد میکنند. رفتار مولکولهای آب در داخل سطح برشی را ایجاد میکنند. رفتار مولکولهای آب در داخل سطح برشی به گونهای است که گویا به کلوئید متصلند و در بیرون این سطح مولکولهای آب غیر وابسته به ذره کلوئیدی میباشند. شکل شماره یک دو لایه فوقالذکر را به صورت شماتیک نشان میدهد.

شکل 2- 1- مدل یک ذره کلوئیدی با لایه دوگانه اطراف آن
لایه انتشاری را میتوان به عنوان یک فضای باردار اطراف ذره کلوئیدی درنظرگرفت. در هر فاصلهای نسبت به سطح ذره تراکم با میزان بار الکتریکی برابر با اختلاف غلظت یونهای مثبت و منفی در آن نقطه خواهد بود. تراکم بار الکتریکی در نزدیک ذره کلوئیدی زیاد بوده و با فاصلهگرفتن از آن و نزدیکشدن تعداد یونهای مثبت و منفی، به صفر نزدیک میگردد.
یونهای با بار مخالف چسبیده به ذره در لایه استرن بعلاوه لایه انتشاری چیزی است که تحت عنوان لایه دوگانه میشناسیم.
ضخامت لایه دوگانه بستگی به غلظت یونها در محلول دارد. بالابودن غلظت یونها در محلول به معنی قابل دسترس بودن یونهای مثبت بیشتر برای خنثیسازی کلوئید میباشد. و در نتیجه آن صخامت لایه دوگانه کاهش مییابد. کاهش غلظت یونها در محلول (مثلاً به دلیل رقیقسازی) باعث کاهش تعداد یونهای مثبت و درنتیجه ضخیم شدن لایه دوگانه خواهد گردید.

شکل2- 2- تغییرات تراکم یونها در لایه انتشاری- با افزایش میزان یونها در محلول ضخامت لایه دوگانه کاهش مییابد.
نوع یونهای با بار مخالف نیز اغلب روی ضخامت لایه دوگانه تأثیر میگذارد. منظور از نوع یونهای با بار مخالف در اینجا ظرفیت (والانس)2 آنها میباشد. برای نمونه، در غلظت مساوی، یونهای آلومینیوم (Al+3) دارای تأئید بیشتری در خنثیسازی بار الکتریکی کلوئید، نسبت به یونهای سدیم (Na+) میباشد و درنتیجه لایه دوگانه در صورت وجود AL+3 دارای ضخامت کمتری خواهد بود.
افزایش غلظت یا ظرفیت یونها باعث فشردگی بیشتر لایه دوگانه میگردد.کلوئید دارای بار منفی و فضای با بار مثبت محاط بر آن ایجاد پتانسیل الکتریکی در لایه انتشاری مینماید. این پتانسیل در سطح ذره بیشترین مقدار را دارد و هرچه از آن دور شویم مقدار آن کاهش مییابد تا نهایتاً در خارج از لایه انتشاری به صفر نزدیک میگردد. منحنی پتانسیل الکتریکی به دلیل اینکه شاخص برای شدت نیروی دافعه بین ذرات و فاصله عمل آن میباشد دارای اهمیت است.
یک نقطه مورد توجه در این منحنی پتانسیل الکتریکی در محل اتصال لایه استرون و لایه انتشاری میباشد که به نام پتانسیل زتا شناخته میشود. پتانسیل زتا بسیار حائز اهمیت میباشد زیرا این پتانسیل با روشی نسبتاً ساده قابل اندازهگیری است در حالی که پتانسیل سطحی را نمیتوان به سادگی اندازهگیری نمود. پتانسیل زتا یک ابزار بسیار کارآ در کنترل فرآیند انعقاد میباشد زیرا تغییر در پتانسیل زتا نشاندهنده تغییر در نیروی دافعه بین کلوئیدها است.

شکل2- 3- مقایسه پتانسیل زتا و پتانسیل سطحی- ارتباط بین پتانسیل زتا و بار سطحی بستگی به غلظت یونها در محلول دارد. در آبهای شیرین با توجه به بزرگبودن لایه دوگانه، پتانسیل زتا تقریب خوبی از پتانسیل سطحی میباشد. ولی در آبهای شور چنین نیست.
نسبت بین پتانسیل زتا و پتانسیل سطحی بستگی به ضخامت لایه دوگانه دارد. پایین بودن میزان جامدات محلول، که معمولاً در تصفیهخانههای آب با آن برخورد میکنیم، باعث بزرگبودن لایه دوگانه میگردد. در این شرایط پتانسیل زتا تخمین خوبی از پتانسیل سطحی میباشد. شرایط در آبهای لب شور و شور متفاوت است، بالابودن غلظت یونها در این حالت باعث فشردگی لایه دوگانه و منحنی پتانسیل زتا تنها بخشی از پتانسیل سطحی میباشد.
1-5- توازن بین نیروهای مخالف
تئوری DLVO (Derjaguin, Landau, Verwery and Overbeek) بیانگر توازن بین دو نیروی مخالف یعنی نیروی دافعه الکترواستاتیک و جاذبه واندروالسی2 برای بیان و توضیح اینکه چرا برخی کلوئیدها تجمعیافته و لخته میشوند و برخی دیگر لخته نمیشوند، میباشد.
1-6- دافعه
نیروهای دافعه الکترواستاتیکی وقتی که دو ذره به یکدیگر نزدیک میشوند و لایه دوگانه آنها
همپوشانی پیدا میکند، بسیار بارز و قابل توجه میگردند. برای فائقآمدن به این نیرو و نزدیککردن دو ذره به یکدیگر نیاز به صرف انرژی میباشد. میزان انرژی مورد نیاز با نزدیک و نزدیکتر شدن ذرات به یکدیگر به شدت افزایش مییابد. برای نشاندادن این انرژی از یک منحنی نیروی الکترواستاتیک مسبب دافعه استفاده میگردد. حداکثر ارتفاع منحنی بستگی به پتانسیل الکتریکی در سطح ذره دارد. (شکل 4)

شکل2- 4- دافعه الکترواستاتیک- اغلب در بخش مثبت منحنی نشان داده میشود

شکل2- 5- جاذبه واندروالسی- اغلب در یک منحنی منفی نشان داده میشود
1-7- جاذبه
نیروی جاذبه واندروالسی بین دو ذره کلوئید در حقیقت نتیجه نیروهای بین مولکولهای مجزا در هر کلوئید است. یعنی یک مولکول موجود در کلوئید اول دارای جاذبه واندروالسی به هر مولکول موجود در کلوئید دوم میباشد. این مسئله برای هر مولکول موجود در کلوئید اول صادق بوده و کل نیروی جاذبه شامل مجموع این نیروهای بین مولکولی خواهد بود.
از منحنی انرژی جاذبه برای بیان تغییرات نیروی جاذبه به نسبت فاصله بین ذرات استفاده میگردد (شکل 5)
1-8- سد انرژی
تئوری DLVO به منظور بیان و توصیف تمایل ذرات برای لختهشدن یا مجزاماندن دو منحنی نیروهای دافعه الکترواستاتیکی و جاذبه واندروالس را ترکیب کرده است. منحنی ترکیبی حاصله منحنی انرژی خالص کنش2 نامیده میشود. در این منحنی که از کمکردن نیروی بیشتر در هر یک از فواصل بدست میآید در صورتی که برآیند نیروها در بالای منحنی قرارگیرد دافعه و در صورتی که در قسمت پایین قرارگیرد جاذبه خواهد بود. (شکل 6)
با تغییر فاصله بین ذرات منحنی انرژی خالص کنش میتواند بین حالتهای جاذبه یا دافعه تغییر کند. به بخش دافعه منحنی سد انرژی گفته میشود و بیشترین مقدار آن نشاندهنده چگونگی مقاومت سیستم به انعقاد و لختهسازی میباشد.
دو ذره کلوئیدی به منظور تجمع بایستی دارای انرژی کینتیکی کافی (ناشی از جرم و سرعت ذره) باشند تا بتوانند از سد انرژی پرش نمایند. در این مرحله با حذف انرژی دافعه ذرات میتوانند به یکدیگر بچسبند و تشکیل لخته دهند و به این ناحیه تله انرژی2 اتلاق میگردد.

شکل2-6- منحنی انرژی خالص کنش
1-9- پایینآوردن سد انرژی
به منظور انعقاد واقعی و کارآ سد انرژی بایستی کاهش یافته و یا به کلی حذف گردد تا کنش خالص همواره جاذبه باشد. این کار توسط فشردهکردن لایه دوگانه و یا کاهش بار الکتریکی سطحی میسر میگردد.
1-10- فشردگی لایه دوگانه
فشردگی لایه دوگانه با اضافهکردن نمک به سیستم صورت میپذیرد. با افزایش غلظت یونی، لایه دوگانه و منحنی انرژی دافعه فشرده شده و سد انرژی از بین میرود. در این شرایط ذرات به سرعت تجمع مییابند زیرا به راحتی و بدون مواجهشدن با سد انرژی میتوانند وارد تله انرژی گردند.(شکل 7)

شکل 2-7- فشردگی لایه دوگانه
1-11- کاهش بار الکتریکی سطحی
در تصفیه آب، ما با اضافهکردن مواد منعقدکننده و کاهش بار الکتریکی سطحی و در نتیجه پتانسیل زتا، سد انرژی را کاهش میدهیم. اینجا دو مسئله حائز اهمیت میباشد. اول اینکه، پتانسیل زتا به دلیل اینکه اندازهگیری مستقیمی از بار سطحی میباشد میتواند به عنوان یک شاخص برای کنترل این فرآیند خنثیسازی بار بکار رود.
دوم اینکه، ضرورتی به کاهش بار تا صفر وجود ندارد. زیرا هدف کاهش سد انرژی است تا نقطهای است که ذرات با توجه به سرعت ناشی از اختلاط بتوانند به آن فائق آیند.
مفهوم سد انرژی در درک این مسئله که چرا در یک محلول ذرات درشتتر لخته میشوند ولی ذرات ریزتر ممکن است بدون لختهشدن از سیستم خارج شوند راهگشا میباشد. با یک سرعت مشخص ناشی از بههمزدن و اختلاط آب ذرات درشتتر به دلیل دارابودن جرم بیشتر دارای انرژی بیشتری بوده و راحتتر از سد انرژی عبور پیدا میکنند. (شکل 8)

شکل2- 8- کاهش بار الکتریکی
2- مکانیسمهای انعقاد و لخته سازی
2-1- انعقاد و سپس لخته سازی
در مباحث مربوط به فرآیند تصفیه آب گاهی از کلمات انعقاد و لخته سازی به جای یکدیگر استفاده میشود البته بهتر است هر یک از این کلمهها در جای مربوطه به کار گرفته شود.
– انعقاد
منظور از انعقاد کاهش یا حذف سد انرژی DLVO میباشد که به آن ناپایدارسازی نیز اتلاق میگردد.
– لخته سازی
منظور چسبیدن موفق ذرات ناپایدار شده، که در اثر تنش هیدرولیکی ناشی از همزدن آب در واحدهای اختلاط سریع و لخته سازی به سمت هم حرکتی میکنند، به یکدیگر میباشد. در ابتدا با چسبیدن چند ذره کلوئیدی، ریز لخته ها تشکیل و سپس با تجمع آنها لخته های قابل مشاهده ایجاد میگردند. انعقاد و لخته سازی توسط یک یا مجموعهای از مکانیزم های زیر صورت میپذیرد:
• فشردگی لایه دوگانه
• خنثیسازی بار الکتریکی
• ایجاد پل بین ذرات2
• به دام افتادن3 کلوئیدها
• انعقاد غیرهمگن4
در ادامه راجع به هر یک از این مکانیزمها توضیح داده شده است.
2-2- فشردگی لایه دوگانه
فشردگی لایه دوگانه با افزودن مقدار زیادی الکترولیت دمای بیتفاوت (مثل کلریدسدیم) صورت میپذیرد. بیتفاوتی در اینجا اشاره به عدم جذب یونها به کلوئید دارد. تغییر غلظت یونی در محلول
موجب فشردگی لایه دوگانه اطراف ذره کلوئیدی میگردد.
براساس تئوری DLVO نتیجه فشردگی لایه دوگانه کاهش و یا حذف سد انرژی دافعه است. درنظرگرفتن این نکته بسیار مهم است که این فرآیند تنها باعث فشردگی ابریونی اطراف ذره کلوئیدی میگردد و لزوماً بار الکتریکی ذره کاهش نمییابد.
به طور کلی این مکانیزم در فرآیندهای انعقاد تصفیهخانههای آب کاربرد چندانی ندارد.

شکل2- 9- فشردگی لایه دوگانه
قانون شولز- هاردی (Schuze- Hardy) قدرت انعقاد یونهای دارای بار مخالف را با میزان بار آنها مرتبط میسازد. براساس این قانون یونهای دوظرفیتی بین 50 تا 70 برابر و یونهای سهظرفیتی بین 600 تا 700 برابر مؤثرتر از یونهای یکظرفیتی میباشند.
2-3- خنثی سازی بار الکتریکی
مواد منعقدکننده غیرآلی مانند نمکهای آهن و آلومینیم و پلیمرهای کاتیونی عمدتاً براساس خنثیسازی بار الکتریکی عمل مینمایند. وقتی که این مواد به آب اضافه میشود تولید یونهای با بار مثبت مینماید به عنوان مثال وقتی نمکهای آهن یا آلومینیوم به آب اضافه میشود دیسوسیه شده و در صورت وجود قلیائیت کافی به هیدروکسیدهای فلزی پیچیده با فرمول
هیدرولیز میگردند. برای یک نمک آلومینیوم برخی از پلیمرهای حاصله عبارتند از:
و برای یک نمک آهن برخی از این پلیمرها عبارتند از:
تشکیل هیدروکسیدهای واقعی بستگی به خصوصیات آب علی الخصوص pH و میزان تزریق مواد منعقدکننده دارد. یونهای مثبت ایجادشده جذب کلوئیدشده و درنتیجه بار منفی آن را خنثی میسازند. این مکانیزم عملیترین روش برای کاهش سد انرژی DLVO و ایجاد لختههای پایدار و کلید تصفیه بهینه قبل از تهنشنینی، فیلتراسیون و شناورسازی میباشد.
خنثیسازی بار الکتریکی به تنهایی نمیتواند عامل تشکیل سریع لختههای درشت باشد. با استفاده از دستگاه سنجش پتانسیل زتا میتوان به راحتی خنثیسازی بار الکتریکی را پایش نمود. این مسئله بسیار حائز اهمیت میباشد زیرا در صورت تزریق بیش از حد مواد منعقدکننده یونهای دارای بار مخالف بیش از حد بهینه جذب کلوئید شده و امکان پایداری مجدد با معکوس شدن بار الکتریکی کلوئیدها وجود دارد. (تبدیل بار منفی آنها به بار مثبت) این اثر علیالخصوص وقتی ما از پلیمرهای کاتیونی با وزن مولکولی کم استفاده میکنیم که امکان ایجاد پل بین کلوئیدها را فراهم نمیکنند بسیار بارز بوده و منجر به انعقاد و لخته سازی غیرمؤثر و ضعیف میگردد. (شکل 10)

شکل2- 10- کاهش بار الکتریکی
2-4- به دام افتادن کلوئیدها
این مکانیزم شامل اضافهکردن مقدار زیادی مواد منعقدکننده به آب میباشد. معمولاً میزان تزریق مواد منعقدکننده مورد استفاده بیشتر از مقدار لازم برای خنثیسازی پتانسیل الکتریکی میباشد. نمکهای فلزی اضافی به شکل
هیدرولیز میگردند. این هیدروکسیدها به شدت در آب نامحلول هستند. با شروع ترسیب این هیدروکسیدها لختههای کوچک و کلوئیدها در بین آنها به دام افتاده و با آنها تهنشین میشوند. این پدیده که به نام انعقاد جاروئی شناخته میشود، در شکل 11 نشان داده شده است. در سالهای اخیر از این فرآیند به عنوان انعقاد پیشرفته و برای حذف برخی آلایندههای خاص استفاده زیادی شده است.

شکل2- 11- انعقاد جاروئی
2-5- ایجاد پل بین ذرات
فرآیند پل زین وقتی اتفاق میافتد که مواد منعقدکننده ایجاد الیاف یا رشتهها و دنبالههایی را مینمایند و این دنبالهها قابلیت چسبیدن و متصلشدن به کلوئیدها را دارند و درنتیجه با اتصال به چنین کلوئید آنها را جمع کرده و تشکیل لخته میدهند. هم مواد منعقدکننده اولیه غیرآلی و هم پلیالکترولیتهای آلی قابلیت ایجاد پل بین ذرات را دارند. هر چه وزن مولکولی این مواد بیشتر باشد دارای مولکولهای بلندتری بوده پلهای مؤثری ایجاد مینمایند. (شکل 12)
مکانیزم پلزنی اغلب به همراه مکانیزم خنثیسازی بار الکتریکی و به منظور رشد سریعتر لختهها و یا ایجاد لختههای مقاومتر در مقابل تنشهای هیدرولیکی بکار میرود. به عنوان مثال در فرآیند انعقاد در ابتدا با استفاده از آلو و با یک پلیمر کاتیونی با وزن کم، خنثیسازی صورت گرفته و سپس با اضافهکردن مقدار کمی پلیمر با وزن مولکولی زیاد که اغلب آنیونی میباشد پلزنی بین ریز لختهها شروع و لختههای درشت و مقاوم تشکیل میگردند. در اینجا منفیبودن بار پلیمر پلزن چندان قابل توجه نیست و ریز لخته ها جذب آن میگردند.

شکل2- 12- ایجاد پل بین ذرات
2-6- انعقاد غیرهمگن
بار سطحی برخی ذرات در آب، به طور طبیعی غیریکنواخت میباشد. جایگاههای با بارهای مخالف میتواند روی سطح ذرات مشابه وجود داشته باشد. مانند آنچه روی ذرات ورقهای رس به چشم میخورد. انعقاد این ذرات کلوئیدی میتواند به واسطه جاذبه ساده الکترواستاتیکی بین این جایگاههای با بار مخالف ایجاد گردد. این مکانیزم که انعقاد غیرهمگن نام دارد میتواند نقش مهمی در لختهسازی جاروئی ایفا نماید.
2-7 – انعقاد پیشرفته(اصلاح شده)
2-8- انتخاب پلیالکترولیت
کاربرد گروهی از منعقدکنندهها که به نام پلیالکترولیتها (یا پلیمرها) شناخته میشوند روز به روز متداولتر میگردد. افزون مقدار مناسب از پلیالکترولیتی که خوب و صحیح انتخاب شدهباشد در عین کاهش حجم لجن و هزینههای تصفیه، کیفیت آب خروجی را بهبود میبخشد.
در صورتی که مبنای مقایسه قیمت هر کیلو منعقدکننده باشد پلیالکترولیتها بسیار گرانقیمتتر از منعقدکنندههای معدنی مانند آلوم یا کلرورفریک میباشند. ولی هزینه کلی بهرهبرداری با توجه به میزان تزریق و حجم لجن کمتر و هزینه کمتر دفع لجن، کمتر خواهد بود. در برخی موارد پلیالکترولیتها به عنوان کمک منعقدکنندهها به همراه منعقدکنندههای سنتی بکار میروند و در برخی موارد به طور کلی جایگزین آنها میشوند.
پلیالکترولیتها مولکولهای درشت آلی میباشند. یک پلیالکترولیت یک پلیمر (بسپاره) است که از تعداد زیادی (پلی) مونومر(مر) تشکیل شده که به یکدیگر متصل میباشند درجه پلیمرازیون نشاندهنده تعداد مونومرهایی میباشد که به یکدیگر متصل شده و یک مولکول پلیمر را تشکیل میدهند تا صدها هزار مونومر باشند.
2-9- انتخاب بهترین پلیالکترولیت
به دلیل در دسترسبودن انواع مختلف پلیالکترولیتها با خصوصیات متفاوت، انتخاب بهترین پلیالکترولیت برای یک منظور خاص کار بسیار دشواری میباشد. از مشخصات زیر معمولاً برای دستهبندی آنها استفاده میشود. اغلب، تولیدکنندگان برخی از این مشخصات را در اختیار میگذارند ولی نه به صورت دقیق و با اطلاعات جزئی و کامل، بلکه معمولاً این اطلاعات ناقص میباشد.
• نوع پلیالکترولیت (آنیونی- غیریونی یا کاتیونی)
• وزن مولکولی
• ساختمان مولکولی
• تراکم بار الکتریکی
• مناسببودن برای تصفیه آب شرب
انجام مطالعات و بررسیهای آزمایشگاهی روی پلیالکترولیتها یک بخش بسیار مهم از فرآیند انتخاب آنها میباشد حتی اگر از این مواد به عنوان کمک منعقدکننده استفاده گردد. اضافهکردن پلیالکترولیتها بدون انجام آزمایش و بدون تعیین میزان بهینه تزریق، غلظت و میزان اختلاط مورد نیاز میتواند مشکلات جدی از جمله گرفتگی صافیها را به دنبال داشته باشد.
تذکر این نکته بسیار ضروری است که پلیمرهای همخانواده یا همنوع میتوانند تفاوتهای بسیار زیادی در وزن مولکولی و تراکم بار الکتریکی داشته باشند. ممکن است یک عضو از یک خانواده پلیمرها برای استفاده مشخصی بسیار مناسب باشد ولی عضو دیگر همان خانواده چنین نباشد.
2-10- خصوصیات پلیمرها
2-10-1- وزن مولکولی
ابعاد کلی یک پلیمر بیانگر میزان مناسببودن آن برای پلزنی بین ذرات میباشد. سایز پلیمرها معمولاً براساس وزن مولکولی آنها بیان میگردد. تولیدکنندگان از یک روش یکسان برای گزارش وزن مولکولی محصولاتشان استفاده نمیکنند. به همین دلیل دو پلیمر که وزن مولکولی آنها یکسان گزارش شده است، ممکن است در حقیقت دارای وزنهای متفاوتی باشند.
بعلاوه وزن مولکولی فقط بیانی از توسط طول پلیمر میباشد و ممکن است طول مولکوها در یک پلیمر متفاوت و طیف گستردهای از اندازهها وجودداشته باشد. این توزیع وزن مولکولی بسیار مهم و یک خصوصیات با اهمیت است.
دامنه وزن مولکولی توصیف کلی
10000000 یا بالاتر خیلی زیاد
10000000 تا 1000000 زیاد
1000000 تا 200000 متوسط
200000 تا 100000 کم
100000 تا 50000 خیلی کم
کمتر از 50000 خیلی خیلی کم
2-10-2- ساختمان
دو پلی الکترولیت مشابه با ترکیب مشابهی از مونومرها، وزن مولکولی و تراکم بار میتوانند به دلیل تفاوت در نحوه اتصال مونومرها به یکدیگر، رفتار متفاوتی داشته باشند. به عنوان مثال در یک محصول که از مونومرهای A و B تشکیل شده است، ممکن است A و B به صورت یک درمیان پشت سرهم قرارگرفته باشند و یا گروهی از مونومرهای A و سپس گروهی از مونومرهای B قراربگیرند.
2-10-3- تراکم بار
تراکم نسبی بار با نسبت مونومرهای استفاده شده دارای بار و فاقد بار کنترل میگردد. هرچه باقیماندههای باردار بیشتر باشد تراکم بار بیشتر خواهد بود. به طور کلی امکان افزایش همزمان تراکم بار الکتریکی و وزن مولکولی وجود ندارد لذا پلیالکترولیت ایدهآل حالت بهینهای از تراکم بار الکتریکی و وزن مولکولی میباشد.
2-10-4- نوع پلیمر
پلیالکترولیتها براساس نوع بار الکتریکی باقیمانده در محلول به سه گروه غیریونی، آنیونی و کاتیونی دستهبندی میگردند.
2-10-4-1- پلیالکترولیتهای غیریونی
این پلیمرها دارای تراکم بار الکتریکی بسیار کمی میباشند. یک نوع بسیار متداول از پلیمرهای غیریونی پلیآکویل آمید است از این پلیالکترولیتها برای پلزنی بین ذرات استفاده میشود.
2-10-4-2- پلیالکترولیتهای آنیونی
این پلیمرها دارای بار منفی هستند از نظر تراکم بار در طیف گستردهای از تقریباً غیریونی تا آنیونی بسیار قوی تولید میگردند. انواع دارای تراکم بار متوسط بیشترین کاربرد را داشته و متداولتر میباشند. اغلب از این پلیمرها برای پلزنی بین ذرات استفاده میشود و آنیونهای دارای پایه آکریل آمید با وزن مولکولی بسیار زیاد برای این منظور بسیار کارآ میباشند.
برخی مواقع کلوئیدهای دارای بار منفی نیز میتوانند توسط پلیالکترولیتهای پلزن با زنجیرههای طولانی لخته میشوند. زیرا چنین کلوئیدی که دارای بار خالص منفی است میتواند دارای موزائیکی از مناطق دارای بار مثبت و منفی باشد و مناطق دارای بار مثبت به عنوان نقاط اتصال به زنجیره پلیمر منفی عمل نمایند.
ممکن است پلیالکترولیتها آنیونی بتوانند ذرات درشت را لخته کنند ولی هنوز بخشی از کلوئیدهای ریز در آب باقی خواهند ماند. به همین دلیل است که قبل از استفاده از پلیالکترولیتهای آنیونی بایستی خنثیسازی بار الکتریکی صورت گرفته باشد.
2-10-4-3- پلیالکترولیتهای کاتیونی
این گروه شامل پلیمرهای با بار مثبت میباشد که دارای محدوده وسیعی از تراکم بار و وزن مولکولی هستند. تنوع بسیار زیاد این پلیمرها از طرفی باعث انعطافپذیری در انتخاب آنها در حل مشکلات خاص انعقاد و لختهسازی میگردد و از طرف دیگر انتخاب نوع مناسب آنها را مشکل میسازد.
پلیالکترولیتهای کاتیونی با وزن مولکولی زیاد میتوانند دو منظوره عمل نمایند زیرا هم باعث خنثیسازی بار الکتریکی و هم پلزنی بین ذرات میگردند.
2-11- کارآیی پلیمرهای پیشرفته
2-11-1- سیستم پلیمرهای دوگانه
از دو پلیمر میتوان به همراه همدیگر و برای کمک به بهبود فرآیند انعقاد استفاده نمود. در این صورت هر یک وظیفه مشخصی را ایفا مینمایند. برای مثال میتوان در ابتدا یک پلیمر کاتیونی با بار زیاد را برای خنثیسازی بار کلوئیدهای ریز اضافه نمود و سپس با اضافهکردن یک پلیمر آنیونی با وزن مولکولی زیاد برای پلزنی بین ذرات، لختههای درشت با سرعت تهنشینی بالا ایجاد نمود. استفاده از سیستم پلیمرهای دوگانه در فرآیندهای تصفیه آب به دلیل نیاز به کنترلهای خاص کمتر متداول میباشد ولی در تصفیه و آبگیری لجن که وجود پلیمر اضافی مشکلات خاص را به دنبال ندارد بیشتر مورد توجه است.
2-11-2- پیش آمادهسازی
وقتی که یک پلیمر به تنهایی در ناپایدارسازی تمام ذرات موفق عمل ننماید استفاده از مواد منعقدکننده معدنی به عنوان کمککننده میتواند به فرآیند انعقاد و لختهسازی کمک نماید. پیشتصفیه با استفاده از منعقدکنندههای معدنی باعث کاهش مصرف پلیمرهای کاتیونی و پایداری بیشتر آنها و درنتیجه نیاز به کنترل کمتر خواهد داشت.

شکل 11- میزان تزریق پلیمر
فیلتراسیون مستقیم با استفاده از پلیمرهای کاتیونی وقتی که کدورت آب ورودی به یک تصفیهخانه کم میباشد امکان حذف فرآیندهای متعارف لختهسازی و تهنشینی یا دورزدن آن وجود دارد که این مسئله باعث کاهش قابل توجهی در هزینههای سرمایهگذاری تصفیهخانههای جدید میگردد. در این صورت آب پس از انعقاد مستقیماً به صافیها منتقل میسازد که به آن فیلتراسیون مستقیم اتلاق میگردد پلیمرهای کاتیونی دراین فرآیند بسیار مؤثر عمل میکنند. در مثال نشان داده شده در نمودار، میزان تزریق پلیمر کدورت آب خروجی و افت ارتفاع در صافی پس از 6 ساعت بهرهبرداری به همراه یکدیگر نمایش داده شده است (شکل 11). کمترین مقدار کدورت خروجی از صافی در صورت تزریق 7 میلیگرم بر لیتر پلیمر ایجاد میشود ولی میزان انتخاب شده 3 میلیگرم در لیتر است زیرا در این دوز، میزان مصرف مواد بهینه، افت ارتفاع حداقل و کدورت خروجی تفاوت زیادی با پایینترین کدورت ندارد.
انتخاب پلیمرهای کاتیونی با روش غربالکردن هزینه حقیقی یک پلیمر قیمت هر کیلوگرم آن نیست بلکه باید براساس هزینه آب تصفیه شده تعیین گردد. با رسم پتانسیل زتا در مقابل میزان تزریق پلیمر روی یک نمودار میتوان دوز پلیمرهای مختلف برای دستیابی به مقدار مشخصی پتانسیل زتا را تعیین کرد.
در مثال نشان داده شده در نمودار بالا دوز مورد نیاز سه نوع منعقد کننده A و B و C برای دستیابی به پتانسیل زتا 5- میلی ولت به ترتیب 3، 8 و 21 میلیگرم در لیتر خواهد بود.
در نتیجه هزینه پلیمر A برای هر میلیون گالن آب معادل 88 دلار، پلیمر B 133 دلار و C نیز 88 دلار خواهد بود. لذا استفاده از نوع A و C اقتصادی میباشد.

شکل 12- پیش آمادهسازی پلیمرها با آلوم
2-11-3- پیشآمادهسازی پلیمرها با آلوم
اثر پیشآمادهسازی را میتوان با رسم پتانسیل زتا در مقابل میزان تزریق پلیمر در سطوح مختلف پیشآمادهسازی شیمیایی ارزیابی نمود. در مثال فوق میزان پلیمر کاتیونی مورد نیاز با تزریق 20 میلیگرم در لیتر آلوم کاهش مییابد در حالیکه تزریق 10 میلیگرم در لیتر چندان مؤثر نیست.
2-12- بستهبندی و تزریق پلیمرها
پلیالکترولیتها را میتوان به شکل پودر، محلول و امولسیون تهیه کرد. هر نوع دارای مزایا و معایبی میباشند. در صورت امکان باید تجهیزات تزریق را طوری انتخاب کرد که توانایی تزریق هر نوعی را داشته باشد.
2-12-1- پلیمرهای پودری خشک
این پودرهای گرانولی سفیدرنگی هستند تمایل به جذب رطوبت هوا، گیرکردن در سیستم تغذیه و ظروف از مشکلات اصلی آن میباشند. پلیمرهای خشک به راحتی حل نمیشوند و معمولاً بین پانزده دقیقه تا یک ساعت زمان نیاز دارند.
2-12-2- پلیمرهای محلول
اغلب پلیمرهای محلول را به نوع پودری آن ترجیح میدهند و متداولتر میباشد. این پلیمرها با مقدار جزئی اختلاط رقیق میشوند. درصد پلیمر فعال در آنها از چند درصد تا 50 درصد میباشد.
2-13-3- پلیمرهای امولسیونی
این نوع پلیمرها در سالهای اخیر بسیار مورد توجه قرارگرفته است. پلیمرهای با وزن مولکولی زیاد را میتوان به شکل امولسیون تهیه نمود. برخی اوقات برای آمادهسازی نیاز به اضافهکردن فعال سازهها میباشد. معمولاً درصد فعال آنها بین 20 تا 30 درصد میباشد.
2-12-4- محلولهای آمادهشده
این محلولها را باید حداکثر در زمانی بین 24 تا 48 ساعت مصرف نمود زیرا در زمانهای طولانیتر فعالیت آنها کمتر میشود.
بعلاوه، به طور معمول وقتی پلیمرها را به صورت رقیقشده به آب اضافه میکنیم مؤثرتر هستند زیرا راحتتر در آب پخش میشوند. وقتی از غلظتهای بالا استفاده کنیم میزان تزریق کمتر خواهد بود بطور معمول حداکثر غلظت تزریق پلیمرها 01/0 تا 05/0 درصد میباشد و محلولهای استوک را بین 1/0 تا 5/0 درصد تهیه میکنند.

شکل 13- استفاده از پلیمرهای کاتیونی
2-13- استفاده از پلیمرهای کاتیونی در آب لبشور
میزان صحیح پلیمرهای کاتیونی در آبهای لبشور، اغلب براساس فشردگی لایه دوگانه که باعث کاهش پتانسیل زتا میشود (و نه پتانسیل سطحی) بررسی میگردد.
رقیقسازی نمونه تصفیهشده با آب مقطر شاخص خوبی برای بررسی اینکه آیا میزان پلیمر کافی بوده یا نه خواهد بود. اگر بار سطحی بالا باشد رقیقسازی باعث افزایش پتانسیل زتا شده و نشان میدهد هنوز باید پلیمر بیشتری اضافه نمود.
2-14- تداخل یون ها
پلیمرهای کاتیونی میتوانند با یونهای موجود در محلول واکنش داده و پیوندهای شیمیایی تشکیل
شده باعث کاهش عملکرد پلیمر میگردد و درنتیجه به مقدار بیشتری پلیمر برای غلبه به این مشکل نیاز خواهد بود. این مسئله اغلب در تصفیه فاضلاب قابل توجه میباشد. مثالهایی از یونهای تداخلکننده، سولفیدها، هیدروسولفیدها و ترکیبات فنلی میباشند ولی حتی کلریدها نیز میتوانند تأثیر پلیمرها را کاهش دهند. حتی pH محلول را باید درنظر گرفت زیرا هر گروهی از پلیمرها در محدوده خاصی از pH مؤثر میباشند.

شکل 14- تداخل فنل- تأثیر فنل روی پلیمر کاتیونی مثال فوق را میتوان با رسم منحنی پتانسیل زتا ارزیابی نمود.

شکل 15- تأثیرات pH – با رسم منحنی پتانسیل زتا میتوان حساسیت پلیمرهای کاتیونی را نسبت به تغییرات pH بررسی نمود. در مورد پلیمر مثال فوق تأثیر pH بسیار زیاد است.
2-15- استفاده از منعقدکنندههای آهن و آلومینیوم
ترکیبات آهن و آلومینیوم جزء منعقدکنندههای سنتی آب و فاضلاب محسوب میگردند. هر دو از یک خانواده هستند که به آنها منعقدکنندههای فلزی میگویند و به طور وسیع مورد استفاده قرار میگیرند. در اغلب تصفیهخانهها از یکی از این دو نوع منعقدکننده استفاده میشود.
منعقدکنندههای فلزی دارای یک مزیت اصلی هستند که ارزانی آنها میباشد. بعلاوه انتخاب میزان بهینه منعقدکننده ساده میباشد. یکی از معایب بزرگ این منعقدکنندهها حجم زیاد لجن تولیدی میباشد که فرآیند آبگیری و تصفیه و دفع لجن را گران میکند.
منعقدکنندههای آهن و آلومینیوم نمکهای محلولی میباشند. این منعقدکنندهها به صورت محلول به آب اضافه میشوند و با قلیائیت آب تولید هیدروکسیدهای نامحلول میکنند و به صورت انعقاد جاروئی و خنثیسازی بار الکتریکی عمل مینمایند.
کاربرد منعقدکنندههای فلزی معمولاً نیاز به توجه خاص به pH و تأمین مقدار لازم قلیائیت در آب دارد. مقدار مناسب مواد منعقدکننده در pH بهینه میباشد. در برخی موارد ممکن است نیاز به اضافهکردن مواد شیمیایی مانند آهک، سودااَش و یا بیکربنات سدیم برای تنظیم pH و تأمین قلیائیت باشد.
2-15-1- سولفات آلومینیوم (آلوم)
آلوم یکی از مواد منعقدکننده متداول با کاربرد گسترده میباشد که میتوان به عنوان یک مثال از منعقدکننده فلزی راجع به آن صحبت کرد. واکنشهایی که در مورد منعقدکنندههای آهن اتفاق میافتد نیز مانند آلوم است لیکن محدوده pH بهینه آنها متفاوت میباشد.
وقتی که سولفات آلومینیوم به آب اضافه میگردد هیدروکسیدهای آلومینیوم تولید میشود که سادهترین آنها هیدروکسید آلومینیوم (Al(OH)3) میباشد که یک رسوب غیرمحلول است. ولی اغلب کمپلکسهای محلول با بار مثبتی ایجاد میشود که عبارتند از:

مقدار هر یک از اینها با توجه به میزان تزریق آلوم و pH آب پس از افزودن آلوم، متفاوت میباشد. در برخی موارد یونهای سولفات
ممکن است در کمپلکس هیدروسهای آلومینیوم جایگزین یونهای
شود که در این صورت بار مثبت کمپلکس کاهش مییابد.
مکانیسم انعقاد توسط آلوم براساس هر دو پدیده خنثیسازی بار الکتریکی و لختهسازی جاروئی میباشد. یکی از این دو پدیده غالب خواهد بود ولی هر دو دارای نقش میباشند. احتمالاً مکانیسم خنثیسازی بار الکتریکی بلافاصله پس از اضافهکردن آلوم به آب اتفاق میافتد. کمپلکسهای با بار مثبت هیدروکسید آلومینیم که به سرعت تشکیل میشوند جذب سطح ذره کلوئیدی دارای بار منفی گردیده باعث خنثیسازی بار (و پتانسیل زتا) و کاهش یا حذف مؤثر سد انرژی DLVO میشوند.
پس از آن رسوب هیدروکسید آلومینیوم تشکیل میگردد. این ذرات باعث کمک و افزایش نرخ لختهسازی از طریق افزایش شانس برخورد و گیرافتادن در لختهها میشود. رسوبات حاصل بدون ارتباط به تعداد لختهها رشد میکنند و کلوئیدها را طی فرآیند لختهسازی جاروئی به دام میاندازند. نوع فرآیند انعقاد غالب بستگی به غلظت آلوم و pH آب پس از افزودن آلوم دارد. به طور کلی وقتی میزان آلوم تزریقی بالاتر از 30 میلیگرم در لیتر باشد انعقاد جاروئی غالب میباشد ولی در مقادیر کمتر نوع فرآیند غالب بستگی به دوز و pH دارد.
برای عملکرد صحیح آلوم نیاز وجود قلیائیت کافی میباشد. در غیر اینصورت مقدار pH به حدی کاهش مییابد که به جای تشکیل رسوب نامحلول هیدروکسید آلومینیوم یونهای محلول (Al+3) تشکیل خواهد شد. یونهای آلومینیوم منعقدکنندههای غیرمؤثری بوده و باعث مشکل ورود آب کثیف به شبکه گردند. واکنش بین آلوم و قلیائیت به شکل زیر میباشد:
2-15-2- تخمین میزان قلیائیت مورد نیاز
معادله فوق ما را در محاسبه سرانگشتی میزان قلیائیت مورد نیاز به ازای دوز آلوم آلوم تزریقی یاری میکند.
آلوم تجاری مادهای کریستالی میباشد که حاوی 2/14 مولکول آب تبلور متصل به هر مولکول سولفات آلومینیوم میباشد. وزن مولکولی
، کربنات
و یون هیدروکسید
میباشد. براساس معادله بالا به صورت سرانگشتی میتوان بیان کرد که:
• به ازای 1 میلیگرم بر لیتر آلوم مصرفی نیاز به 5/0 میلیگرم بر لیتر قلیائیت میباشد.
• پس از انعقاد وجود بین 5 تا 10 میلیگرم بر لیتر قلیائیت برای حفظ pH درحد بهینه ضروری است.
• بنابراین میزان قلیائیت در آب خام بایستی معادل نصف میزان آلوم تزریقی به اضافه 5 تا 10 میلیگرم بر لیتر باشد.
1 میلیگرم در لیتر قلیائیت بر حسب
معادل است با:
• 66/0 میلیگرم بر لیتر آهک 85% (CaO)
• 78/0 میلیگرم بر لیتر آهک آبدار 95% (Ca(OH)2)
• 80/0 میلیگرم بر لیتر سود کاستیک (NaOH)
• 08/1 میلیگرم بر لیتر سودا؟؟؟ (Na2Co3)
• 52/1 میلیگرم بر لیتر بیکربنات سدیم (NaHCo3)
2-15-2- سولفات فرو
برای واکنش سریع، قلیائیت مورد نیاز سولفات فرو بایستی به شکل یونهای هیدروکسید باشد. درنتیجه میزان اضافهنمودن آهک آبدار Ca(OH)2 بایستی به قدری باشد که pH در حد مناسب افزایش یابد. واکنش حاصله از نوع واکنشهای اکسیداسیون- احیا بوده و نیازمند وجود مقدار کافی اکسیژن محلول در آب میباشد. در واکنش انعقاد اکسیژن محلول احیا و آهن دوظرفیتی (فرو) به سه ظرفیتی (فریک) اکسید میگردد. واکنش شیمیایی ساده شده آن عبارت است از:
برای ایجاد واکنش pH بایستی تا بالاتر از 5/9 افزایش یابد و برخی اوقات برای ایجاد پایداری بایستی آهک اضافهتر نیز بکاربرد. انعقاد با سولفات فرو و آب آهک اغلب پرهزینهتر از استفاده از آلوم میباشد. معمولاً رسوبات حاصله که به شکل هیدروکسید آهن میباشند، محکمتر و دارای سرعت تهنشینی بیشتری نسبت به لختههای آلومینیوم هستند. سولفات فرو به شکل مایع و خشک وجود دارد که نوع خشک آن متداولتر است. نوع خشک به شکل دانهای و کلوخهای ارائه میگردد که نوع دانهای دارای کاربرد بیشتری میباشد.
این گرانولها دارای 55% سولفات فرو حاوی هفت آب تبلور هستند. جرم حجمی آنها بین 1010 تا 1060 کیلوگرم به ازای هر مترمکعب بوده و به شکل خشک به آب اضافه میگردند. شیوه دیگر استفاده از سولفات فرو کلرینهکردن آن در حین تصفیه میباشد. در این فرآیند سولفات فرو با کلر واکنش داده و آهن دو ظرفیتی (فرو) به سه ظرفیتی (فریک) اکسیده میگردد.
2-15-4- سولفات فریک2
واکنش ساده این ماده با قلیائیت طبیعی آب که به شکل بیکربنات میباشد عبارت است از:
در صورت اضافهنمودن آب آهک خواهیم داشت:
محدوده پی- اچ بهینه برای این ماده نیز بین 4 تا 12 و لختهها سنگین و دارای سرعت تهنشینی زیاد میباشند. کلرور فریک به شکل جامد در دو نوع، پودر و کلوخه، و مایع وجود دارد. نوع کلوخهای 59 تا 61 درصد FeCl3 و شش آب تبلور دارد. جرم حجمی آن 960 تا 1026 کیلوگرم بر مترمکعب میباشد. نوع پودری فاقد آب تبلور و دارای 98% کلرور فریک میباشد. جرم حجمی این نوع بین 1360 تا 1440 کیلوگرم برمترمکعب است. نوع مایع دارای بین 37 تا 47 درصد کلرور فریک است.
لخته سازی
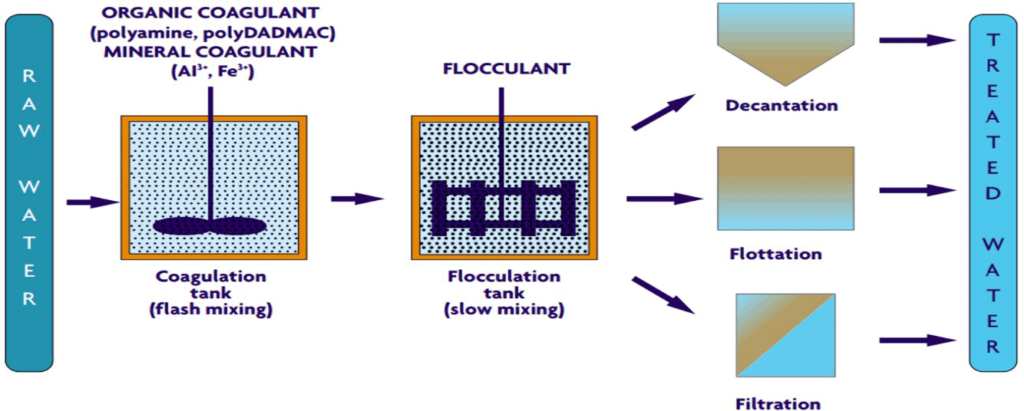
3- لخته سازی
توان مورد نیاز برای اختلاط آرام آب طی لختهسازی توسط همزن مکانیکی یا پنوماتیکی ایجاد میگردد که نوع مکانیکی آن متداولتر میباشد. گاهاً از مخازن راهبنددار نیز برای لختهسازی استفاده میشود هر چند در این حالت محدوده G و GT قابل دسترسی وسیع نخواهد بود و به همین دلیل این روش گسترش چندانی پیدا نکرده است. متداولترین نوع همزن مکانیکی همانگونه که در شکل 15-2 نشان داده شده است نوع پاروئی میباشد. اگر چه از انواع توربینی و ملخی نیز اغلب استفاده میشود.
درجه کامل شدن فرآیند لختهسازی وابسته به راحتی و سرعت تجمع میکروفلاکها (ریزلختهها) و تبدیل آنها لختههای درشت و کل تعداد تجمع ذرات طی عمل لختهسازی میباشد. بنابراین درجه تکامل فرآیند وابسته به خصوصیات لختهها، گرادیان سرعت G و مقدار GT خواهد بود. بزرگی مقدار پارامتر بدون بُعد GT وابسته به کل تعداد برخوردها در حین تجمع در فرآیند لختهسازی است. بالابودن مقدار GT نشاندهنده بالابودن تعداد برخوردها در حین تجمع میباشد. پارامتر دیگر GCT است که در آن C نسبت حجم لخته به کل حجم آب در حال لختهسازی میباشد. اگر گرادیان سرعت در لختهسازی خیلی بزرگ باشد نیروی برش موجب جلوگیری از تشکیل لختههای بزرگ میشود. اگر گرادیان سرعت ناکافی باشد برخورد کافی بس ذرات اتفاق نخواهد افتاد و لختههای مناسب تشکیل نخواهد شد.
مخازن لختهسازی معمولاً برای لختهسازی مرحلهای یا کاهنده (tapered flocculation) طراحی میشوند. به گونهای که با عبور آب از میان مخزن مقدار G به تدریج کاهش مییابد. این عمل باعث تشکیل سریع لختههای کوچک و وزین در مراحل اول مینماید که در مراحل بعدی باکاهش مقدار G به یکدیگر چسبیده و تولید لختههای بزرگ با سرعت تهنشینی بالا میکنند. در لختهسازی کاهنده معمولاً مقدار G در مرحله اول (از سه مرحله لختهسازی) زیاد، در مرحله دوم کمتر و در مرحله سوم خیلی کمتر ازمرحل قبلی خواهد بود. برای مثال مقادیر G میتواند 80، 40 و 20 باشد. اگر چه در بسیاری از طرحها از این نوع لختهسازی استفاده نمیشود ولی حالت بهینه لختهسازی، نوع کاهنده آن میباشد.
نحوه استقرار لختهسازهایی که از همزن پاروئی با شفت افقی استفاده میکنند در شکلهای 16-2 و 17-2 نشان داده شده است. درالگوی جریان متقاطع (Cross Flow Pattern). شکل 16-2 (a) شفت همزن پاروئی عمود بر جهت جریان و در الگوی جریان محوری (axial flow pattern) شفت موازی جهت جریان میباشد.
برای به حداقل رسانیدن جریان میانبُر همانگونه که در شکلهای 16-2 و 17-2 نشان داده شده است حداقل به سه بخش مجزا نیازمندیم. برای جداکردن بخشها از یکدیگر از تختهچوبهای افقی که بین آنها برای عبور جریان فاصله وجود دارد و یا از دیوارههای جداکننده بتنی دارای روزنه استفاده میشود. استفاده از تختهچوب انعطافپذیری را افزایش میدهد و فاصله باز بین آنها قابل تغییر میباشد. استفاده از لختهسازهای چند بخشی علاوه بر کاهش جریان میانبُر لختهسازی کاهنده را نیز میسر میسازد. در لختهسازهای دارای الگوی جریان متقاطع، لختهسازی کاهنده با تغییر در اندازه پاروها، تعداد آنها و قطر پاروها در شفتهای مختلف امکانپذیر است. هر چند که این کار با تغییر دور در شفتهای مختلف نیز میسر میباشد در لختهسازهای دارای الگوی جریان محوری، لختهسازی کاهنده با تغییر اندازه پارو و تعداد پاورها روی هر شفت مشترک بوجود میآید. کل تجهیزات مکانیکی باید برای منطبقشدن با تغییرات کیفی آب دارای موتورهای دوره تغییر با طیف تغییرات 1:4 باشند. اگر از دیوارهای بتنی دارای روزنه استفاده شود بایستی جلوی روزنههااز پخشکننده جریان استفاده گردد گرادیان سرعت در این روزنهها نباید از گرادیان سرعت در بخش قبلی آن بیشتر باشد. گرادیان سرعت در این روزنهها را میتوان با استفاده از افت فشار h بدست آمده از معادله روزنهها محاسبه کرد معادله روزنه عبارت است از:
که در آن Q بر حسب فوت مکعب درثانیه، A سطح مقطع روزنه بر حسب Ft2 و h بر حسب Ft میباشد. سرعت و زمان عبور از روزنه T با استفاده از این رابطه قابل محاسبه بوده و مقدار گرادیان سرعت از معادله
که در آن
میباشد بدست میآید.
برخی نوسانات از همزنهای پارویی با شفت عمودی استفاده میشود (شکل 18-2 a و b) طرح کلی لختهسازهایی که از چنین همزنهایی استفاده میکنند در شکل c 18-2 نشان داده شده است همانگونه که از شکل مشخص میباشد نحوه استقرار این لختهسازها به صورتی است که جریان به حالت سری از بخشهای مختلف لختهساز عبور کرده و جریان میانبُر به حداقل برسد و اغلب از لختهسازی کاهنده استفاده میشود.
توان اعمالشده به آب توسط همزن پاروئی را میتوان با استفاده از قانون نیوتن در ارتباط با نیروی دراگ (drag force) برای اجسام متحرک در زیر مایعات محاسبه کرد. نیروی دراگ برای همزنهای پاروئی برابر است با:

که در آن:

از آنجا که توان برابر نیرو در سرعت میباشد داریم:
که در آن:
ضریب دراگ بستگی به وضعیت هندسی پاروها دارد، مقادیر این ضریب برای پاروهای با ابعاد مختلف در جدول شماره 3-2 ارائه شده است.

در عمل مشخص گردیده که سرعت محیطی پاورها باید بین 3/0 تا 3 فوت در ثانیه باشد و سرعت نسبی تیغهها به آب حدوداً
سرعت محیطی تیغهها میباشد. کل سطح تیغهها نباید از 15 تا 20 درصد کل سطح مقطع مخزن بیشتر گردد.
در طراحی یک مخزن لختهساز با همزن دارای محور افقی ابتدا گرادیان سرعت G و زمانماند T در آزمایشگاه و یا با استفاده از مطالعات پایلوت تعیین میگردد سپس مقدار GT محاسبه شده و از مناسببودن مقدار آن و قرارداشتن در محدوده مورد قبول اطمینان حاصل شود. سپس با استفاده از دبی جریان و زمانماند حجم مخزن V محاسبه میگردد. ابعاد حوضچه با دانستن حجم آن و تعداد محورهای افقی تعیین میگردد اگر از لختهسازی کاهنده استفاده شود بایستی مقدار G برای هر بخش با استفاده از مطالعات آزمایشگاهی یا پایلوت مشخص گردد. سپس یک همزن پاروئی فرضی طراحی میشود و سرعت محیطی پاروها برای اعمال توان مناسب به آب محاسبه میگردد. اگر سرعت محیطی بدست آمده زیاد باشد از پاروهای بزرگتر یا تعداد بیشتر پارو استفاده شده و محاسبات تکرار میشود تا به شرایط مناسب برسیم.
از سایر همزنهای مکانیکی مانند همزنهای توربینی، پروانهای یا ملخی نیز به طور موفقیتآمیز استفاده شده است لیکن همزنهای پاروئی متداولتر میباشند.
مثال: یک مخزن لختهسازی با جریان متقاطع و همزن پاروئی با شفت افقی برای جریان MGD 6.5 طراحی شده است، گرادیان سرعت متوسط S-1 30 (در دمای F 50 دقیقه است. مقدار GT باید از نوع کاهنده و مخزن دارای سه بخش با عمق مساوی بوده و بخشها به صورت سری قرارگیرند. مقادیر G برای هر یک از این بخشها بر اساس مطالعات آزمایشگاهی به ترتیب معادل G1=50 Sec-1 ،
G2=25 Sec-1 و G3=15 Sec-1 بدست آمده است که متوسط آن معادل S-1 30 خواهد بود. کف مخازن همسطح بوده و توسط تختههای چوبی از یکدیگر جدا میشوند. عرض مخزن به خاطر اتصال به مخزن تهنشینی بایستی 50 فوت باشد. سرعت تیغهها نسبت به آب معادل
سرعت شعاعی تیغهها میباشد محاسبه کنید:
1- مقدار GT
2- ابعاد مخزن
3- طراحی همزن پاروئی
4- توانی که باید در هر بخش به آب اعمال گردد
5- سرعت چرخش هر یک از محورهای افقی بر حسب دور در دقیقه rpm
6- اگر از همزن دور متغیر با نسبت 1:4 استفاده میشود محدوده قابل تنظیم سرعت چرخشی
7- سرعت محیطی آخرین پرههی همزن پاروئی
حل:
چون مقدار GT باید بین 50000 تا 100000 باشد زمانماند 50 دقیقه مناسب میباشد.
فرض میکنیم سطح مقطع هر بخش مربع بوده و طول هر ضلع آن X باشد.
14Ft-3in یا X=14.18 یا 3X(X)=603.46Ft2
3X=3(14Ft-3in)=42Ft-9in
=42Ft-9in طول =14Ft-3in عمق
=(14025)(42.75)(50.0)=30459Ft3 حجم مخزن
فرض کنید یک از همزن پاروئی مطابق شکل 15-2 با مشخصات زیر استفاده شده است:
ِD1=5.5Ft D2=8.5Ft D3=11.5Ft
بر روی هر محور چهار همزن پاروئی نصب میگردد. ابعاد تیغههای این ؟؟؟؟ 6in x 10Ft میباشد و فاصله باز بین تیغهها 12 in است.
=0.5Ft x 10Ft x 6 x 4=120Ft2 سطح تیغه در هرمحور
درصد مساحت تیغهها به سطح مقطع مخزن
چون این مقدار بین 15 تا 25 قرار دارد قابل قبول است و محاسبات بعدی انجام میشود.

توان در بخش اول برابر است با:
توان به ازای هر همزن برابر است با:
=(690Ft-1b/Sec1/4=172.60Ft-1b/Sec توان
P=0.97CDAV3
سرعت پروانهها نسبت به

با همین روش

چون سرعت محیطی کوچکتر از 3 میباشد طراحی مناسب است. چون حداکثر سرعت چرخش 4.38 دور در دقیقه است و نسبت تغییر دو
بوده بنابراین حداقل آن برابر است با :
با همین روش برای بخشهای دیگر مخزن نیز پارامترهای مورد نیاز بدست میآید.

ته نشینی و شناور سازی
Sedimentation & Floatation

4- ته نشینی و شناور سازی
ته نشینی و شناور سازی دو فرایند تصفیه هستند که طی آنها آب در یک تانک با سطح مقطع بزرگ برای مدت معلوم نگه داشته می شود. در این تانک که سرعت جریان در آن محدود است ،مواد معلق موجود در آب به دو صورت می توانند از آب جدا شوند. مواد معلق با وزن مخصوص بزرگتر از آب به طرف پایین و مواد با وزن مخصوص کوچکتر از آب به طرف بالا حرکت می نمایند. به فرآیند نوع اوّل ته نشینی (sedimentation) و به فرآیند نوع دوم شناور سازی (floatation)اطلاق می شود. مواد ته نشین شده بصورت لجن (sludge) وسط سیستم روی لجن روب و مواد شناور شده بصورت سرباره (scum)توسط کف روب جمع آوری شده و آب زلال شده از حوض خارج می گردد. سرعت حرکت مواد معلق موجود در آب به طرف پایین یا بالا علاوه بر وزن مخصوص بستگی به قطر آنها دارد، همچنین موادی که چگالی آنها نزدیک به آب باشد و با قطر کمتر از 10میکرون باشد ، به سختی ته نشین یا شناور می شوند، که به این مواد ،مواد کلوئیدی گفته می شود. در بخش های قبلی ذکر گردید، برای افزایش قطر مواد از فرایند های انعقاد و لخته سازی استفاده می شود. همچنین برای کاهش چگالی مواد و سهولت در شناورسازی مواد کمکی مانند حباب های ریز هوا استفاده نمود. در شکل (5-1)طرح ساده ته نشینی و شناورسازی مشاهده می شود.

4-1 ته نشینی (sedimentation)
ته نشینی فرآیندی است که در آن مواد معلق درآب توسط نیروی ثقل و به علت چگالی بالاتر از آب از آن جداشده و ته نشین می شوند.این فرآیند یکی از عمومی ترین مراحل در تصفیه خانه های متعارف میباشد.
4-1-1 ته نشینی ساده یا سطحی (plain sedimentation)
در صورتی که مواد معلق بطور طبیعی (بدون ایجاد تسریع مصنوعی)به هم چسبیده و در اثر نیروی ثقل سقوط کنند ، ته نشینی از نوع سطحی نامیده می شود. در این نوع ته نشینی لجن روبی برنامه ریزی شده وجود ندارد و هر از چند گاهی که میزان لجن ته نشین شده از حد مجاز بیشتر می شود ، اقدام به لاروبی مسیر می گردد. ته نشینی سطحی معمولاً در حوض های بزرگ یکسان سازی (equalization tanks) در مواقعی که آب به هنگام رودخانه ها برای ورود به تصفیه خانه در نظر گرفته شده است،استفاده میگردد. تعداد حوض های ته نشینی ساده یا سطحی حداقل دو واحد و زمان مانداب در آن بیشتر از یک روز در نظر گرفته می شود .در این صورت مزایا و معایب استفاده از این حوض ها به صورت زیر خواهد بود:
الف- مزایا :
– یکسان سازی کیفیت آب ورودی بطوری که تغییرات کیفی آب بطور بطئی و در زمان بیش از یک روز معنی دار میشود. بدین ترتیب می توان به نتایج آزمایشات چار تست برای تعیین مقدار مواد شیمیایی و شدت گرادیان سرعت مورد استفاده در مراحل انعقاد و لخته سازی اعتماد نمود. چرا که زمان تغییر کیفیت آب بسیار بزرگتر از زمان موردنیاز برای انجام آزمایشات و تعیین دوز مواد شیمیایی می باشد.
– ایجاد ذخیره آب به میزان حداقل مصرف یک روز تصفیه خانه و افزایش ضریب اطمینان
– ته نشینی اولیه مواد معلق درآب و بهبود کیفیت آب از نظر کدورت و غلظت مواد جامد معلق بخصوص در مواقعی که از آب به هنگام رودخانه ها استفاده می شود.
– افزایش غلظت اکسیژن در آب تا حد غلظت اشباع به علت زمان ماند زیاد و اختلاط سطحی و انتقال مناسب اکسیژن
– کاهش غلظت مواد محلولی چون یون آمونیم (NH4+) و مواد میکروبی و ویروسها در آب، نرخ این کاهش بسته به اینکه رژیم جریان در این حوض ها از نوع قالبی (plug flow) یا با اختلاط کامل باشد ، از روابط زیر محاسبه می گردد.

که در روابط فوق K ضریب ثابت می باشد که بستگی به دما ، شدت تابش خورشید ، ضریب پراکندگی، وجود مواد یا ارگانیسمهای مصرف کننده در آب و … دارد و با مطالعات پایلوتی قابل دستیابی است و T زمان مانداب در هر حوضچه بر حسب روز است و از رابطه زیر حاصل می گردد:

که در آن Veحجم مؤثر یا مفید حوضچه بر حسب متر مکعب و Qدبی جریان بر حسب متر مکعب بر روز می باشد.طبیعی است که هر چه نسبت حجم مرده به حجم کل حوضچه بیشتر شود (جریان کوتاه بیشتری اتفاق بیفتد)، حجم مؤثر حوض کاهش مییابد.
ب- معایب :
– به علت سطح بزرگ این حوضچه ها و عدم امکان احداث آنها بصورت روبسته احتمال تولید جلبک در آنها افزایش می یابد که میتواند در مراحل بعدی تصفیه ایجاد دردسر نماید.برای کاهش اثرات تولید جلبک می توان به صورت زیر عمل نمود:
• پوشش بخشی از حوضچه های ته نشینی ساده با صفحات شناور که باعث تعدیل تولید جلبک می گردد.
• استفاده از واحد های میکروتوری بعد از حوضچه ها و حذف مواد جلبکی قبل از ورود آنها به تصفیه خانه
– اشغال اراضی زیاد به علت بار سطحی اندک و زمان ماند زیاد
– استفاده از مواد اکسید کننده و گندزدا برای کشتن و یا جلوگیری کردن از افزایش جلبکی به علت تأثیرات جنبی و مصرف بالای مواد شیمیایی توصیه نمی شود.
– در برخی از کشورها که دمای حداکثر آب ورودی محدود است ، از ماهیهای ویژه لجن خوار در حوض های ته نشینی استفاده می گردد. این ماهیها اقدام به خوردن تجزیه مواد جلبکی و لجن می نمایند و به علت پایین بودن دمای آب تخم ریزی و تکثیر ندارند.
4-1-2 انواع ته نشینی:
ته نشینی به صورت های مختلف می تواند صورت پذیرد. از این میان به چهار حالت مشخص اشاره می گردد:
1. ته نشینی نوع اول: در این نوع ته نشینی ذرات معلق درآب به صورت کاملاً مجزا از یکدیگر و بصورت مستقل سقوط می کنند (Discrete sedimentation). نمونه ای از این نوع ته نشینی در حوض های دانه گیر و سیلت زدایی اتفاق می افتد.
2. ته نشینی نوع دوم : در این نوع ته نشینی، مواد معلق در آب در طول مسیر سقوط به هم چسبیده و بزرگتر می شوند و سرعت ته نشینی آنها به تدریج تغییر می نماید.
3. ته نشینی نوع سوم: این نوع ته نشینی زمانی اتفاق می افتد که غلظت مواد معلق موجود در آب بقدری افزایش یافته باشد که مواد به هم چسبیده و ایجاد یک ناحیه غلیظ که به ابر لجن یا پتوی لجن (Sludge Blanket)معروف است، نمایند. دراین صورت کل ناحیه به وجود آمده ، به صورت یکپارچه شروع به ته نشینی می نماید. لذا به این نوع ته نشینی ناحیه ای (Zone Settling) نیز می گویند.
4. ته نشینی نوع چهارم: در این حالت به علت فشردگی بیش از حد مواد جامد آب حاوی مواد جدا شده و در اثر فشردگی به طرف بالا حرکت کرده و مواد جامد باقیمانده تغلیظ می گردد. بدین سبب به این نوع ته نشینی فشرده (Compressed Settling)گفته می شود. از این نوع ته نشینی معمولاً در حوضچه های تغلیظ استفاده می گردد.
4-1-3- انواع حوض های ته نشینی مورد استفاده در تصفیه خانه های آب
حوض های ته نشینی را می توان بصورت های مختلف دسته بندی کرد:
الف : از نظر جهت جریان : حوض های ته نشینی از نظر جهت جریان به دو دسته با جریان افقی و با جریان عمودی تقسیم می شوند.
ب:از نظر شکل( پلان) حوض : خوضهای ته نشینی ازنظر پلان افقی به دودسته حوضهایمستطیلی و حوضهای دایره ای تقسیم می شوند .
در شکل (5-2) حوضهای ته نشینی با جریان افقی و در شکل شماره (5-3)حوضهای ته نشینی با جریانهای عمودی مشاهده می گردند. (شکلهای 1-5 و 1-7IHE)
ج_حوضهای تقویت شده (با نرخ بالا)(High Rate Settling Tanks)
این نوع حوضه های ته نشینی می توانند به هردو صورت با جریان افقی یا با جریان عمودی ، مستطیلی یا دایره ای وجود داشته باشند و فرق عمده آنها ااستفاده از صفحات افقی یا مورب و یا سیستم های لوله ای مورب برای افزایش سطح ویژه ته نشینی ، کاهش شعاع هیدرولیکی جریان و عدد رینولدز و افزایش عدد فرود و در نتیجه کاهش زمان ماند مورد نیاز و حجم حوض می باشد. مهمترین عامل تقویت ته نشینی در این حوضها افزایش سطح ویژه و تبدیل رژیم جریان از اختلاط کامل به پلاگ می باشد. در شکل (5-4)مققطع دو نمونه از این نوع حوضهای ته نشینی مشاهده می گردد.(شکل 1-6IHE)
د- حوضهای تماس لجن یا رآکتوری : دراین حوضها با ایجاد ضریب تماس بالای مصنوعی توسط ایجاد پالس های متناوب (نوع پولساتوری ) و یا با برگشت بخشی از لجن خروجی به بخش لخته سازی اقدام به تقویت شرایط لخته سازی و تهنشینی می گردد.
در شکل (1-5)چهار نمونه ا ز این نوع حوضها مشاهده میگردد.
4-2-تئوری ته نشینی :
4-2-1- ته نشینی نوع اول:
از صفحه 26(آخر صفحه ) تا صفحه 51 با تغییر شکل 2-8
در سقوط آزاد ذرات مجزا زمانی که ذره به سرعت حد خود می رسد نیروی ثقل با مجموع نیروهای شناوری واصطکاکی به تعادل می رسد.

زمانی که ذره به سرعت حد خود می رسد
یعنی شتاب ذره به صفر می رسد لذا

در روابط بالا :
mجرم ذره- kg
-سرعت سقوط ذره –m/sec
-نیروی ثقل – N
– نیروی شناوری – N
– نیروی اصطکاکی – N
– جرم مخصوص ذرات –
– جرم مخصوص آب –
– حجم ذره –
-سطح مقطع ذره –
g-شتاب ثقل –
– ضریب اصطکاک
– قطر معادل ذره –m
می باشند.
یا ضریب اصطکاک تابعی از شرایط اغتشاش حرکت ذره (عدد رینولدز)در حرکت ذره در مایع می باشد.
چنانچه مشاهده می شود در صورت کوچک بودن (جریان لامینار ) ضریب اصطکاک تقریباً مساوی ترم اول رابطه فوق خواهد بود. در شکل 2-18 تغییرات در قبال تغییر خطر ذرات معلق برای ذرات کروی ، با دانسیته های مختلف دیده می شود.
در حالت لامینار خواهیم داشت:
که در آن ویسکوزیته سینماتیک مایع می باشد:
با جاگذاری CDو در رابطه اصلی سرعت ته نشینی رابطه استوکز(Stokes)حاصل می گردد.
برای حالتی مه عدد رینولدز بسیار بالا باشد ترمهای اول و دوم در قبال رقم سوم قابل اغماض بوده و عملاً خواهیم داشت
و برای مراحل گذار از فرمول کلی استفاده خواهد گردید. مثلاً موارد زیر در نظر گرفته می شود.
در حالت بزرگتر بودن سرعت ته نشینی از بار سطحی هیدرولیکی ذره معلق حتماً درحوض ته نشین خواهد شد.با تقسیم بندی حوض ته نشینی با جریان افقی به چهار منطقه ورودی ، خروجی ، بخش لجن و بخش ته نشینی بار سطحی برابر خواهد بود با حاصل تقسیم دبی طراحی بر سطح افقی ناحیه ته نشینی
لذا اگر زمان ماند آب در حوض ته نشینی بدون در نظر گرفتن جریانهای میان برد بگونه ای انتخاب شود که در این زمان ذره ورودی از بالاترین نقطه ناحیه ورودی بتواند در آخرین نقطه ناحیه ته نشینی به کف حوض برسد . حجم بهینه حوضچه حاصل گردیده است.
که درآن:
H ارتفاع ناحیه تهنشین – m
t زمان ماند ساعت
بار سطحی m/h
H,W,L طول و عرض و ارتفاع ناحیه ته نشینی (m,m,m)
Q دبی طراحی
و سرعت افقی جریان m/h می باشند.
پس
بنابراین کلیه ذراتی که دارای سرعت ته نشینی بیش از سرعت طراحی ( )باشند، حتماً رسوب خواهند نمود و بقیه مواد نسبت به این که از چه ارتفاعی از ناحیه ورودی به بخش ته نشین وارد می شوند به صورت بخشی از کل مواد باقیمانده ته نشین خواهند شد.
یعنی اگر زمان ماند بزرگتر از زمان رسیدن ذره به کف استخر باشد خواهیم داشت :
که درآن :
ارتفاع ورود ذره mاست.
اگر منحنی تجمعی درصد ذرات نسبت به سرعت ته نشینی آنها رسم شود ، درصد ذرات با سرعت ته نشینی کمتر از برابر با و ذرات با سرعت بیش از به میزان ( )خواهد بود. از سوی دیگر سطح بالای منحنی تجمعی نشانگر کل ذرات ته نشین شده می باشد(شکل 2-19)
لذا چنانچه در شکل 2-19 دیده می شود اگر سطح قسمت هاشور زده را به سرعت طراحی تقسیم کنیم ، درصد بخش ته نشین شده ذرات با سرعت ته نشینی کوچکتر از مشخص خواهد گردید. لذا خواهیم داشت :
درصد کل حذف مواد معلق
بطوریکه ملاحظه می شود مقدار انتگرال سطح ناحیه هاشور خورده بوده و با تقسیم آن بر عرض معادل آن بدست خواهدآمد.
آگر منحنی سقوط ذرات در حوض ته نشین رسم شود ، منحنی ذرات با سرعت بیش از دارای شیب بیشتر و منحنی ذرات با سرعت کمتر از دارای شیب کمتری خواهد بود.شکل (2-20)مقایسه این منحنی ها را نشان می دهد.
جدول شماره ( ) سرعت ته نشینی دانه های کروی شکل با چگالی های مربوط به عدد طبیعی مثل ماسه ، سیلت ، رس و لخته های آلومینیوم و آهکی را نشان می دهد.
در شکل ( )شرایط ته نشینی مواد با سرعت ته نشینی مختلف در یک حوض با جریان افقی مشاهده می شود. شکل 32-5 JUWA
چنانچه ملاحظه می گردد ، هرچه سرعت ته نشینی مواد موجود در آب بیشتر از بار سطحی حوض ته نشینی (70) باشد ، درصد حذف مواد بیشتر خواهد بود . به عبارت دیگر با کاهش بار سطحی در حوض ته نشینی در صد حذف مواد معلق در آب بیشتر خواهد بود. در شکل (-4- )رابطه میزان مواد حذف شده با سطح حوض ته نشینی و بار سطحی در حوض ته نشینی مشااهده می گر
4-2-2 ته نشینی نوع دوم
این نوع تهنسینی با استفاده از مواد منعقدکننده برای ازدیاد قطر و وزن ذرات معلق صورت می پذیرد . برای تعیین میزان ته نشینی مواد معلق به صورت درصدی از کل مواد ، نیاز به آزمایشات ته نشینی به صورت Batchمی باشد.در هرآزمایش مخلوط هموژن شده به مدت مشخص اجازه ته نشینی می یابد ، سپس از ارتفاعهای مشخصی که دارای شیر برداشت می باشد ، نمونه برداری شده و غلظت مواد معلق نسبت به غلظت اولیه برای ارتفاع مربوطه سنجیده شده ودرصد حذف مواد روی یک دستگاه مختصات که محور طولی آن زمان و محور عرضی آن عمق می باشد ترسیم می شود.سپس با وصل کردن نقاط هم درصد حذف ، منحنی های Rبدست می آیند. لازم به توضیح است که غلظت اولیه و شرایط سوسپانسیون درکلیه آزمایشها باید یکسان بوده و درجه حرارت مایع در طول آزمایش بیش از یک درجه سانتی گراد تغییر نکند.
شکل 2-21 حاصل یک سری از این آزمایشات را نشان می دهد که منحنی های هم راندمان به نامهای تا درآن نشان داده شده اند.(از 100% حذف تا 40%حذف )
مثلاً اگر زمان ماند حوض ته نشینی باشد ، درصد حذف مواد معلق به صورت زیر محاسبه می گردد:
از رابطه ذکر شده
همچنین رابطه دیگری نیز که در این محاسبات مورد استفاده قرار می گیرد ، به صورت زیر می باشد
که درآن R آخر همان 100% و یا 1 می باشد.
تا در رابطه اول عبارت است از عمق نقطه میانی بین دومنحنی حذف از سطح آب در مدل آزمایشی هستند، درحالیکه در رابطه دوم تا صرفاً فاصله عمودی بین دو منحنی حذف می باشند.
چنانچه ملاحظه می شود با استفاده از دومنحنی بدست آمده می توان با انتخاب درصد حذف طراحی زمان ماند و بار سطحی حوض مورد نظر را بدست آورد. سپس با توجه به این که دبی طراحی از جمله موارد داده شده مسئله می باشد(از روی مطالعات مصرف آب بدست آمده است .) با داشتن زمان ماند حجم حوض بدست می آید
و با داشتن بار سطحی از روی منحنی مربوطه می توان سطح حوضچه را محاسیه نمود.
و البته ارتفاع حوض نیز از تقسیم حجم حوض بر سطح آن بدست می آسد. باید توجه داشت که حجم بدست آمده در رابطه بالا حجم مفید حوض بوده و حجم فضاهای مرده باید به آن اضافه گردد. هرچه حجم فضاهای مرده و یا مسیر های جریان کوتاه در حوض کمتر باشد ابعاد حوض کوچکتر و بر هزینه اجرایی آن تأثیر خواهد گذاشت .
مثال:
آگر نتایج قید شده در شکل 2-21 را ناشی از انجام آزمایشات ستون ته نشینی در نظر بگیریم مطلوبست :
– تعیین زمان ماند مورد نیاز و بار سطحی قابل قبول برای حذف 65% مجموعه مواد معلق ورودی به حوض .
– تعیین حجم ، سطح و ارتفاع حوض ته نشینی در صورتی که دبی طراحی برابر 0.8متر مکعب در ثانیه باشد .
حل: با استفاده از دو رابطه تعیین درصد حذف در زمانهای مورد نظر برای زمان t=16min نقطه برخورد منحنی نقاط هم راندمان حذف 20% با خط افقی به عمق 10فوت خواهیم داشت.
فیلتراسیون
5- فیلتراسیون
فرآیند فیلتراسیون یکی از واحدهای فیزیکی تصفیه آب است که برای حذف مواد معلق از آب کارگرفته میشود. مثالهایی از این ذرات، میکروارگانیسمها، رسوبات مواد هیومیک2، ذرات رس و سیلت، کلوئیدها و ذرات آلی حاصل از تجزیه و تخریب گیاهان رسوبات آهن یا آلومینیوم مورد استفاده در انعقاد، رسوبات کربنات کلسیم و رسوبات آهن و منیزیوم میباشند.
با توجه به نقش اساسی صافی در حذف میکروارگانیسمهای بیماریزا، از جمله عوامل مقاوم به گندزدایی همچون کیست ژیاردیا3، صافیها به عنوان قلب تصفیهخانههای متعارف آب سطحی و دارای نقش کلیدی در تصفیه آب میباشند. همچنین صافیها جزء پرهزینهترین اجزاء تصفیهخانه به حساب میآیند.
5-1-مکانیزم حذف مواد معلق در صافی
مکانیزم حذف مواد معلق در صافیها پیچیده بوده و کاملاً شناخته شده نیست. ولی میتوان عنوان نمود که مجموعهای از عملکردهای فیزیکی، شیمیایی و بیوشیمیایی با توجه به شرایط و مشخصات مختلف سوسپانسیون، مواد و مصالح صافی، کیفیت آب ورودی، نرخ فیلتراسیون و روش بهرهبرداری دراین عمل مؤثرند. نظر به اینکه بیشتر فعالیتهای شیمیایی و بیوشیمیایی روی سطح دانههای صافی صورت میپذیرد بعضی از مکانیزمهای عامل جذب و تجمعه مواد معلق روی این دانهها به شرح زیر عنوان میگردند:
5-1-1- صافشدن یا غربالشدن مکانیکی (Mechanical straining)
این فرآیند فقط وقتی صورت میگیرد که روزنههای بستر صافی کوچکتر از قطر مواد معلق باشند. با توجه به اینکه حتی با داشتن مصالح فیلتری با اندازه مؤثر 4/0 میلیمتر قطر متوسط روزنهها بین مصالح کمی بیشتر از 60 میکرون (شکل 1) خواهد بود این فرآیند تأثیر زیادی در حذف ذرات کلوئیدی (با قطر 1/0- 001/0 میکرون) با کتریها (با اندازه 1 تا 10 میکرون) و یا حتی لختههای آهن یا آلومینیوم (با قطر 20 تا 50 میکرون) ندارد. ممکن است برخی مواد معلق در گوشههای ایجادشده بین مصالح صافی گیر بیافتند. از طرف حرکت آب در روزنهها ایجاد گرادیان سرعت نموده و موجب حرکت مواد میگردد. با گذشت زمان و ایجاد گرفتگی، قطر روزنه کاهش یافته و به صورت نظری کارآئی فرآیند غربالشدن افزایش خواهد یافت. در فرآیند فیلتراسیون تند عمل غربالشدن تنها بخش ناچیزی از بار معلق را حذف میکند. در جاهایی که آب حاوی ذرات معلق درشت میباشد این فرآیند حائز اهمیت فراوانی خواهد بود. زیرا باعث افزایش سریع افت فشار میگردد و در این شرایط بایستی از مصالح بستری درشتتری استفاده نمود در صافیهای تکلایه غربالشدن عمدتاً در چند سانتیمتر بالای صافی صورت میپذیرد.
ضریب فیلتراسیون برای فرآیند غربالشدن مکانیکی از سرعت یا نرخ فیلتراسیون مستقل بوده و از فرمول زیر تبعیت میکند:
که در آن ضریب فیلتراسیون و قطر مصالح صافی میباشد لذا هر چه قطر مصالح صافی کوچکتر باشد راندمان این مکانیزم بیشتر خواهد بود.
5-1-2- تهنشینی (Sedimentation)
تهنشینی روی سطح مصالح صافی یکی دیگر از فرآیندهای حذف مواد معلق با اندازه ریزتر از قطر روزنههای صافی است که کاملاً شبیه فرآیند تهنشینی در مخازن تهنشین میباشد. البته در مخازن رسوبات در کف تجمع مییابند در حالی که در صافی در روی سطح مصالح بستر، امکان تهنشینی و تجمع رسوب وجود دارد. تهنشین در صافیها ز کلاس یک (1) یا تهنشینی مجزا محسوب شده و سرعت آن بر اساس قانون استوک (Stokes) محاسبه میگردد.
اگر میزان تخلخل بستر یک صافی معادل P درصد باشد یک مترمکعب از مصالح کروی شکل صافی با قطر dg دارای (P-1) مترمربع سطح حاصل خواهد بود. ب ه عنوان مثال در یک صافی با تخلخل 4/0 (40%) و دانهبندی 8/0 میلیمتر 4500 مترمربع سطح تهنشین به ازای هر مترمکعب مصالح صافی قابل دسترسی میباشد که اگر عمق صافی را 2/1 متر درنظر بگیریم معادل 5400 مترمربع به ازای هر متر سطح صافی خواهد بود. اگر حتی بخش کوچکی از این سطح مؤثر باشد (سطحی که رو به بالا بوده و در تماس با سایر دانهها و در معرض روبندگی نیست) مقدار آن به حدود 300 مترمربع به ازای هر مترمربع سطح بستر صافی خواهد رسید. در این صافی اگر نرخ فیلتراسیون 4/5 متر در ساعت باشد میزان بار سطحی حدود 018/0 مترمکعب به متر مربرع در ساعت خواهد بود. و ذراتی کهسرعت تهنشین آنها معادل یا بیشتر از بار سطحی باشد حذف خواهند شد. سرعت تهنشین با توجه به قانون استوک برابر است با:
که در آن قطر ذرات معلق، دانسیته جرمی آب و دانسیته جرمی ذره معلق ، شتاب ثقل و ویسکوزیته کینماتیک سیال میباشد که مقدار آن برای آب 10 درجه سانتیگراد معادل 10-631/1 (مترمربع در ثانیه) است اگر نسبت برای مواد معلقی که 95% آب جذب نمودهاند معادل 1/0 باشد در این صورت سرعت تهنشین برابرخواهد بود با:
بنابراین اگر بار سطحی معادل سرعت تهنشینی و برابر با 018/0 متر در ساعت یا 6-105 متر در ثانیه باشد خواهیم داشت:
بنابراین ذرات با قطر بزرگتر از 11 میکرومتر بر اثر تهنشین حذف خواهند شد. با ادامه فیلتراسیون و کاهش قطر منافذ صافی به دلیل تهنشینی مواد سرعت واقعی عبور جریان افزایش مییابد که با جلوگیری از تهنشینی مواد جدید (براساس نظریه آیوز Ives) و یا کندن و حرکتی دادن مواد تهنشینشده به سمت انتهای صافی (براساس نظریه مینتز Mintz) باعث عبور مواد از صافی و کاهش کیفیت آب خروجی خواهد شد.
ضریب فیلتراسیون برای فرآیند تهنشین بستگی به ویسکوزیته آب، نرخ فیلتراسیون و قطر مصالح فیلتری دارد.
همانگونه که مشخص میباشد با کاهش قطر یا اندازه مؤثر مصالح بستر صافی به دلیل افزایش سطح تهنشینی راندمان این فرآیند و ضریب فیلتراسیون افزایش مییابد به عنوان مثال اگر به جای استفاده از مصالح با دانهبندی 8/0 میلیمتر از مصالحی با دانهبندی 3/0 میلیمتر (با همان تخلخل 4/0) استفاده گردد سطح کل از 4500 مترمربع به ازای هر مترمکعب بستر، به 12000 متر مربع به ازای هر مترمکعب افزایش خواهد یافت.
5-1-3- جذب سطحی (Adsorption)
بسیاری از دانشمندان معتقدند که مهمترین و اساسیترین مکانیزم حذف ناخالصیهای آب در فیلترهای تند ماسهای پدیده جذب سطحی میشوند عبارتند از نیروهای الکترواستاتیک، جاذبه جرمی و پتانسیل الکتروسینتیک. جذب سطحی زمانی اتفاق میافتد که فاصله ذره از سطح فیلتری به (1-01/0 میکرون) محدود باشد. اما چون سطح دانه توسط یک فیلم آب با ضخامت بیش از حد ذکر شده پوشیده شده است، ذره میبایست از طریق مکانیزمهای انتقال که ذیلاً به توضیح مختصر آنها خواهیم پرداخت از این فیلم عبور کرده و خود را به سطح دانه برساند. تأثیر این مکانیزمه بستگی به مشخصات مواد فیلتری، مواد معلق، آب و نرخ فیلتراسیون دارد.
5-2- مکانیزمهای انتقال (Transport Mechanisms)
تحلیل این مکانیزمها نشانگر چگونگی انتقال ذره از مخلوط به فاصله نزدیک دانهها میباشد. در زیر به مهمترین مکانیزمهای انتقال اشاره شده است.
5-2-1- نیروی ثقل (Gravity):
در این حالت ذرات با وزن مخصوص بزرگتر از آب به طرف پایین حرکت میکنند و ذرات بزرگتر مستقیماً روی دانهها مینشینند و ذرات کوچکتر به نزدیکی دانهها رسیده و سپس با نیروی جاذبه ایجاد شده از آب جدا میگردند. در این حالت راندان حذف بستگی به وزن مخصوص ذره و آب، ویسکوزیته آب و بالطبع درجه حرارت محیط دارد.
5-2-2- دیفوژن:
ذرات کوچک دراثر حرکت براونی به صورت شانسی به طرف سطح دانههای فیلتری نزدیک شده و جذب آنها میشوند. هر چه ذره کوچکتر باشد تأثیر دیفوژن بیشتر خواهد شد و ذرات بزرگتر از 2 میکرون نمیتوانند از آن تأثیرپذیرند. این حرکت هنگامی که شرایط جریان به توربولانت نزدیک میشود مؤثرتر خواهد بود.
دیفوژن و حرکت ثقلی دو مکانیزم اساسی در فیلتراسیون آب هستند که دیفوژن برای ذرات با قطر کوچکتر از 1 میکرون و حرکت ثقلی برای ذرات با قطر بزرگتر از 1 میکرون مؤثرند. لذا کمترین راندمان انتقال مواد در فیلتراسیون زمانی اتفاق میافتد که قطر ذرات حدود 1 میکرون باشد.
برای اینکه راندمان حذف مواد معلق با قطر حدود 1 میکرون بیشتر شود با استفاده از مواد منعقدکننده و لختهسازی قطر مواد را افزای میدهند.
5-2-3-مکانیزمهای دیگر انتقال
مکانیزمهای دیگر انتقال عبارتند از:
– تأثیرات هیدرودینامیک زمانی که ذره شکل کروی کامل نداشته و دراثر نیروی هیدرودینامیکی دچار چرخش و حرکتهای راندم میشود.
– جداسازی یا جداشدن زمانی که ذره خیلی به دیواره دانه فیلتری نزدیک شده باشد.
– اینرسی در مواقعی که ذره در اثر نیروی اینرسی مسیر خود را طی میکند ولی خطوط جریان تغییر میکنند.
5-3- کندهشدن (Detachment)
در اثر فرآیند فیلتراسیون تخلخل بین دانهها به تدریج توسط ذرات و فلوکها گرفته شده و اگر نرخ فیلتراسیون ثابت بماند باعث ازدیاد سرعت واقعی جریان از داخل محفظههای تخلخل میشود. لذا، نیروی اصطکاک بین جریان و مواد تهنشینشده افزایش یافته و دراثر نیروی حاصله ذرات از روی دانههای فیلتری کنده شده و به عمق پایینتری حمل میشوند. گرفتگی فیلتر زمانی اتفاق میافتد که دیگر کندهشدن ذرات صورت نگیرد (اَیوز و مکی) بنا به تعریف آقای مینتز مقدار کندهشدگی رابطه مستقیم با مقدار مواد تهنشینشده دارد.
یا به عبارتی
که در آن رسوب ویژه (مقدار جرم یا حجم رسوبات در واحد حجم بستر فیلتری)، زمان و ضریب ثابت میباشد.
(چانگ، ادین و ربون) این فرمول را با مدل خود تطبیق داده و به فرمول زیر رسیدهاند:
که در آن K ضریب کندهشدن و J گرادیان هیدرولیکی است.
لذا میتوان چنین نتیجه گرفت که:
– جداشدن ذراتی که قبلاً روی مواد فیلتری نشستهاند یکی از فاکتورهای گرفتگی است.
– کندهشدن زمانی که اندازه دانههای فیلتری متوسط یا درشت باشد بیشتر اتفاق میافتد.
– اگر ارتفاع فیلتر زیاد باشد از گرفتگی کامل جلوگیری میکند ولی افت فشار در لایههای بالا شدیداً زیاد شده و رسیدن آن به فشار بخار اشباع و ایجاد حبابهای بخار آبگرفتگی به شکل دیگری اتفاق میافتد.
دو مکانیزم یا فرآیند چسبیدن و کندهشدن به طور مداوم در فیلترها اتفاق میافتند.
تئوریهای ریاضی فیلتراسیون؛ کیفیت آب خروجی
به منظور سادهکردن محاسبات در تئوری ریاضی فیلتراسیون فرض میکنیم که بستر تمیز یک صافی با عمق L از ذرات کرویشکل یکنواخت با قطر و تخلخل تشکیل گردیده است. در طی فیلتراسیون ناخالصیهای آب خام به سطح ذرات صافی منتقل میشود. یعنی از طرفی غلظت یا مقدار ناخالصیهای آب خام ورودی در عمق از سطح صافی به و به در خروجی کاهش مییابد (شکل 6) و از طرف دیگر قطر دانههای موجود در عمق ثابت از به افزایش و تخلخل از به کاهش مییابد بنابراین با نرخ ثابت فیلتراسیون سرعت واقعی جریان از میان فضاهای خالی صافی از به افزایش خواهد یافت.
برای کلیه مسائل مکانیک در معادله، یعنی معادله حرکت (motion) و پیوستگی (Continuity) وجود دارد. برای غلظت ناخالصیهای منتقله توسط آب از بین صافی که آن را با C نشان دادیم نیز این فرض که میزان کاهش متناسب با غلظت میباشد (قانون فیک Fick’s law) صادق خواهد بود. از این فرض معادله زیر منتج میگردد:
که در آن ضریب یا ثابت تناسب میباشد و به عنوان ضریب فیلتراسیون نامیده میشود. معادله پیوستگی را نیز میتوان به شکل زیر نوشت:
رسوب + ذخیره + خروجی= ورودی
که در صورت ساده نمودن داریم:
با تغییر عمق غلظت تغییر زیادی مییابد اما تغییر آن نسبت به زمان بسیار اندک است، با استفاده از این موضوع معادله را باز هم سادهتر مینماییم.
در این معادلات غلظت وزنسنجی (gravimetric) ناخالصیها میباشد. البته کاهش فضاهای خالی با غلظت حجمسنجی (Volumetric) محاسبه و سنجیده میگردد.
که در آن دانسیته جرمی ذرات یا ناخالصیهای جداشده میباشد.
برای حل سریع معادلات ارائه شده در بالا بایستی مقدار را بدانیم. بدینمنظور ملاحظات تئوریکی کمک چندانی نخواهد نمود و مقدار بایستی به صورت تجربی و با استفاده از پایلوت محاسبه گردد. با استفاده از یک پایلوت و داشتن در ترکیبات متفاوتی از و خواهیم داشت:
اگر را در مقابل رسم کنیم
گرافی مشابه شکل 7 به دست میآید افزایش ابتدایی مقدار به دلیل افزایش راندمان مکانیسم غربالشدن مکانیکی با شروع گرفتگی رسوبات و افزایش راندمان جذب ذرات معلق به سطح مصالح صافی پس از تشکیل پوشش ژلاتینی و جذب ذرات اولیه میباشد. با افزایش گرفتگی سرعت بینابین (Intersital Velocities) از به افزایش یافته و درنتیجه رسوبات کنده شده و مقدار کاهش مییابد.
در نهایت سرعت روبندگی در حدی افزایش مییابد که دیگر به ناخالصیها اجازه انتقال از سیال به سطح ماسهها را نمیدهد. وقتی که کیفیت خروجی به حد غیرقابل قبول رسید دوره عملکرد صافی پایان یافته و وقت شستشوی آن فرا میرسد.
بیش از 50 محقق مقدار را به عنوان تابعی از محاسبه نمودهاند. لیکن به دلیل تفاوتهایی که در ترکیب آب مورد تصفیه وجود داشته به روابط متفاوتی دست یافتهاند. برخی از این روابط عبارتند از:
آیوز و دیاپر (Ives and Diaper)
ایواساکی، املیا و علی Iwasaki, O’melia and Ali
Lerk, Shektman
Mackrle (1) Deb
Maroudas
روابط کاملتری نیز ارائه شده که برخی از آنها عبارتند از:
Adin and Rebhon
Ives (1)
Ives (2), Mahanka
Mackrle (2)
در این روابط ضرایب و تونهایی میباشند که بایستی به صورت تجربی محاسبه گردند. به منظور انجام محاسبات بعدی تئوری ماروداس (Maroudas) را با جایگزینی به جای پی میگیریم:
معنی این رابطه این است که وقتی فضاهای خالی با رسوبات پرشوند فیلتراسیون متوقف خواهد بود و این اساس معادلات دیفرانسیل خواهد بود.
حذف
گرفتگی
با درنظرگرفتن شرایط مرزی ، ، ،
با تعریف معادل حل معادلات فوق به شرح زیر خواهد بود:
و
که مقدار متوسط آن خواهد بود:
برای نتایج واقعی، مقایسه اثرات نرخهی متفاوت فیلتراسیون و اندازه دانهبندی مصالح صافی هنوز باید مقادیر و (و ) مشخص باشد. تمامی محققین با دانستن این موضوع این رابطه را پیدا کردهاند کل نتایج را میتوان به شکل زیر نوشت:
که در آن ویسکوزیته کینماتیک میباشد.
مقادیر a و b و c با توجه به ترکیبات آب متفاوت خواهد بود.
c b a
1.67 0 1 Fair
2.5 0 0 Hall (1)
1 1 1 Hall (2)
1.4 4 -1.4 Ison
1 1 2 Ives and sholji
1 1 0 Iwasaki
3 1 1 Lerk
1.5 0 0 Ling
2 1 -0.5 Mackrle
0 1 0 Maroudas
1.7 0.7 0 Mintz and krishtul
1.35 0.25 1 Mohanka
2.46 1.56 0 Stanley
3 0 0 Stein
اگر تئوری لرک Lerk را دنبال نماییم و درنظرگرفتن ثابت تناسب معادل 18-10(9) میباشد.
,
و با فرض 67/0= و kg/m3 50 = (سیلت با 98% آب) و 38/0 = و در دمای 10= و
با استفاده از فرمول ، عمق یا ضخامت لایه فیلتری برای یک دوره فیلتراسیون را میتوان محاسبه نمود.
فرض کنید و و و با مقادیر و محاسبه شده در قبل خواهیم داشت
برای مقادیر مختلف و ، عمق مورد نیاز برای بستر صافی برابر خواهد بود با:
mm/s 4 3
m 1.14 0.86 L = 0.57
1.48 1.11 0.74 0.8
1.91 1.43 0.95 0.9
2.44 1.83 1.22 1.0